13.6:
Bir Reaksiyonun Yarı Ömr
13.6:
Bir Reaksiyonun Yarı Ömr
Bir reaksiyonun yarı ömrü (t1/2), belirli bir reaktant miktarının yarısının tüketilmesi için gereken süredir. Sonraki her bir yarılanma ömründe, reaktantın kalan konsantrasyonunun yarısı tüketilir. Örneğin, hidrojen peroksitin ayrışması sırasında, ilk yarılanma ömrü boyunca (0.00 saatten 6.00 saate kadar), H2O2 konsantrasyonu 1,000 M’den 0,500 M’ye kadar. İkinci yarılanma ömrü sırasında (6.00 saatten 12.00 saate), konsantrasyon 0,500 M’den 0,250 M’ye düşerken, üçüncü yarılanma ömrü boyunca 0,250 M’den 0,125 M’ye düşmektedir. Birbirini izleyen 6.00 saatlik periyotta H2O2 konsantrasyonu yarı yarıya azalır.
Birinci dereceden bir reaksiyonun yarı ömrü, reaktan konsantrasyonundan bağımsızdır. Bununla birlikte, diğer dereceli reaksiyonların yarı ömürleri, reaktanların konsantrasyonlarına bağlıdır.
Birinci Dereceden Tepkimelerin Yarı Ömrü
Birinci dereceden bir reaksiyonun yarı ömrünü hız sabitiyle ilişkilendiren bir denklem, entegre hız yasasından türetilebilir:
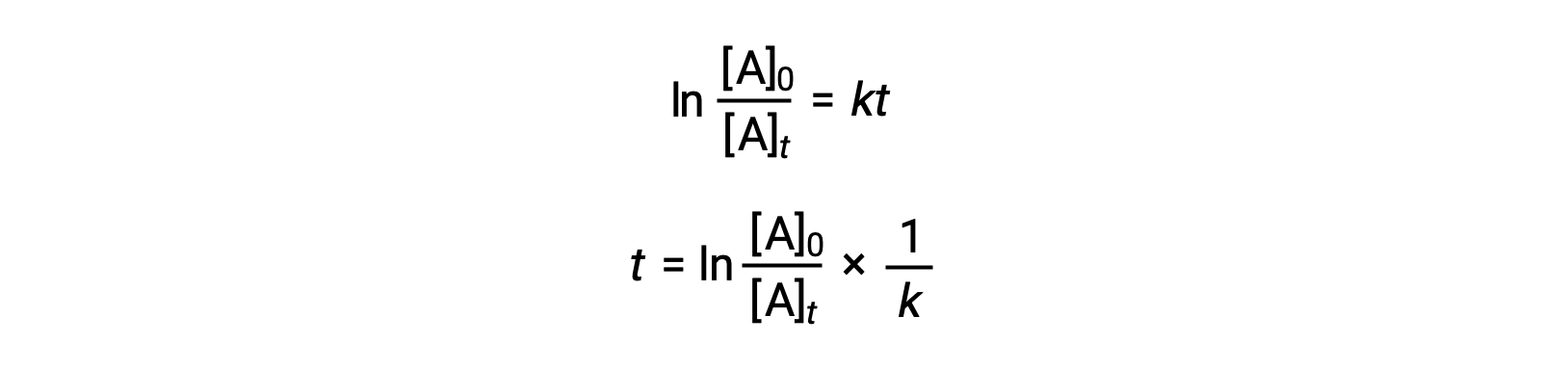
Yarı ömür tanımına göre t1/2 zamanında, reaktan A’nın konsantrasyonu, başlangıç konsantrasyonunun yarısıdır. Bu nedenle; t=t1/2 ve [A]t =½[A]0.
Bu terimleri yeniden düzenlenmiş entegre hız yasasına dönüştürmek ve basitleştirmek, yarı ömür denklemini verir:
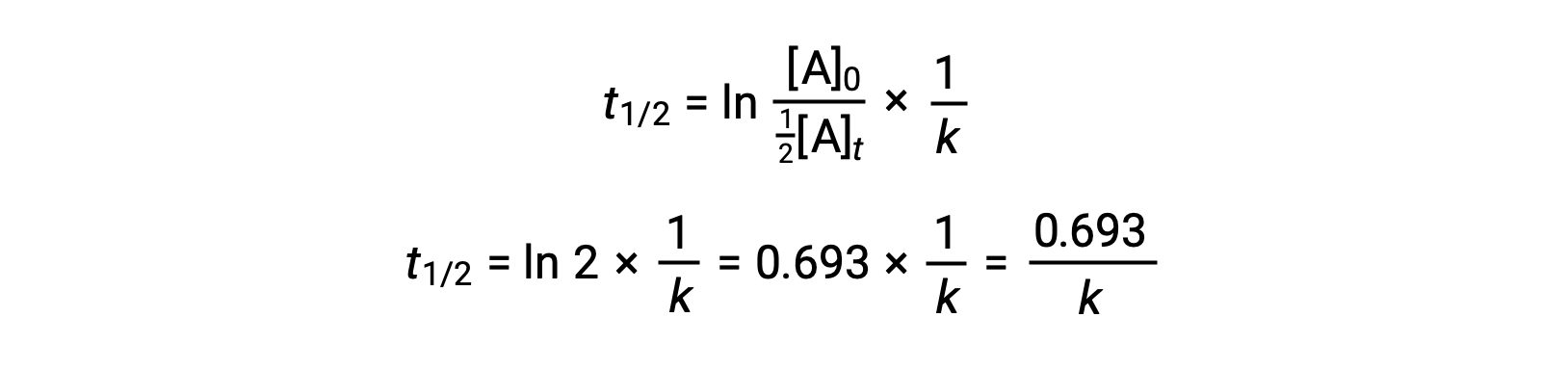
Bu yarı ömür denklemi, reaksiyonun yarı ömrü ile hız sabiti k arasında beklenen ters ilişkiyi açıklar. Daha hızlı reaksiyonlar daha büyük hız sabitleri ve buna bağlı olarak daha kısa yarı ömürler sergilerken, daha yavaş reaksiyonlar daha küçük hız sabitleri ve daha uzun yarı ömürler sergiler.
İkinci Derece Tepkimelerin Yarı Ömrü
Birinci dereceden reaksiyonlarla aynı yaklaşımı izleyerek, ikinci dereceden reaksiyonun yarı ömrünü hız sabiti ve başlangıç konsantrasyonuyla ilişkilendiren bir denklem, entegre hız yasasından türetilebilir:
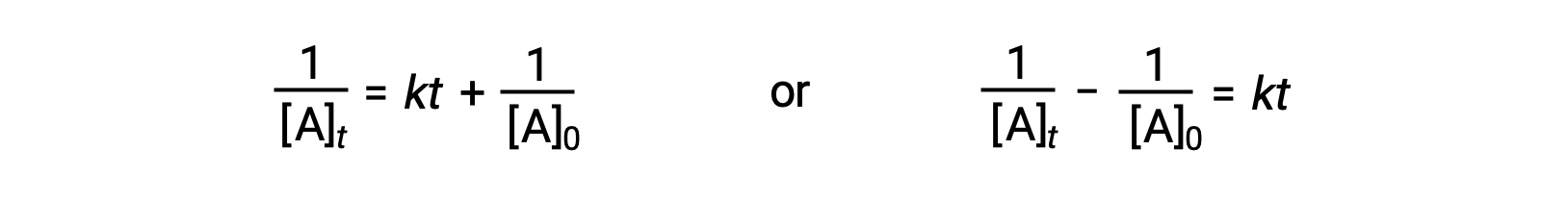
t=t1/2 ve [A]t = ½[A]0, entegre hız yasası basitleştirildi:

İkinci dereceden bir reaksiyon için t1/2, reaktantın konsantrasyonu ile ters orantılıdır ve yarı ömür, reaksiyon ilerledikçe artar çünkü reaktan konsantrasyonu azalır. Birinci dereceden reaksiyonlardan farklı olarak, ikinci dereceden reaksiyonun hız sabiti, ilk konsantrasyon bilinmedikçe doğrudan yarı ömürden hesaplanamaz.
Sıfır Dereceli Reaksiyonların Yarı Ömrü
Sıfır dereceli yarı ömür için bir denklem, entegre hız yasasından da türetilebilir:

t=t1/2 ve [A]t=½[A]0, sıfır derece entegre hız yasasında şunu verir:

Sıfır dereceli bir reaksiyonun yarı ömrü, hız sabitiyle ters orantılıdır. Bununla birlikte, sıfır dereceli bir reaksiyonun yarı ömrü, başlangıçtaki konsantrasyon arttıkça artar.
Bu metin bu kaynaktan uyarlanmıştırOpenstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
