12.10:
Descenso del punto de Congelamiento y Elevación del Punto de Ebullición
12.10:
Descenso del punto de Congelamiento y Elevación del Punto de Ebullición
Elevación del punto de ebullición
El punto de ebullición de un líquido es la temperatura a la que su presión de vapor es igual a la presión atmosférica ambiente. Dado que la presión de vapor de una solución se reduce debido a la presencia de solutos no volátiles, es lógico que el punto de ebullición de la solución aumente posteriormente. La presión de vapor aumenta con la temperatura, y por lo tanto una solución requerirá una temperatura más alta que el solvente puro para lograr cualquier presión de vapor dada, incluyendo una equivalente a la de la atmósfera circundante. El aumento del punto de ebullición observado cuando un soluto no volátil se disuelve en un disolvente, ΔTb, se denomina elevación del punto de ebullición y es directamente proporcional a la concentración molal de las especies de soluto:
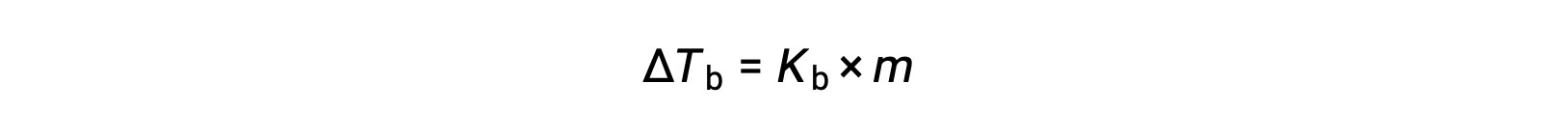
Donde Kb es la constante de elevación del punto de ebullición, o la constante ebulloscópica y m es la concentración molal (molalidad) de todas las especies de solutos. Las constantes de elevación del punto de ebullición son propiedades características que dependen de la identidad del disolvente.
Depresión del punto de congelación
Las soluciones se congelan a temperaturas más bajas que los líquidos puros. Este fenómeno es explotado en esquemas de “anticongelante” que utilizan sal, cloruro de calcio o urea para derretir hielo en carreteras y aceras, y en el uso de etilenglicol como “anticongelante” en radiadores de automóviles. El agua de mar se congela a una temperatura más baja que el agua dulce, por lo que los océanos Ártico y Antártico permanecen descongelados incluso a temperaturas inferiores a 0 °C (al igual que los fluidos corporales de los peces y otros animales marinos de sangre fría que viven en estos océanos).
La disminución del punto de congelación de una solución diluida en comparación con la del disolvente puro, ΔTf, se denomina depresión del punto de congelación y es directamente proporcional a la concentración molal del soluto
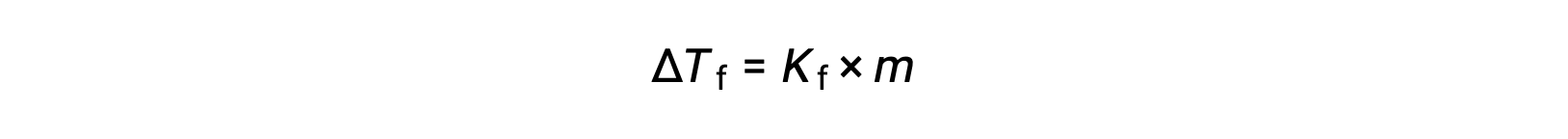
Donde m es la concentración molal del soluto y Kf se llama constante de depresión del punto de congelación (o constante crioscópica). Al igual que para las constantes de elevación del punto de ebullición, son propiedades características cuyos valores dependen de la identidad química del disolvente.
Determinación de masas molares
La presión osmótica y los cambios en el punto de congelación, punto de ebullición y presión de vapor son directamente proporcionales al número de especies de soluto presentes en una cantidad determinada de solución. En consecuencia, la medición de una de estas propiedades para una solución preparada utilizando una masa conocida de soluto permite determinar la masa molar del soluto.
Por ejemplo, una solución de 4,00 g de un no electrolito disuelto en 55,0 g de benceno se congela a 2,32 °C. Suponiendo un comportamiento de solución ideal, ¿cuál es la masa molar de este compuesto?
Para resolver este problema, primero se calcula el cambio en el punto de congelación a partir del punto de congelación observado y el punto de congelación del benceno puro:
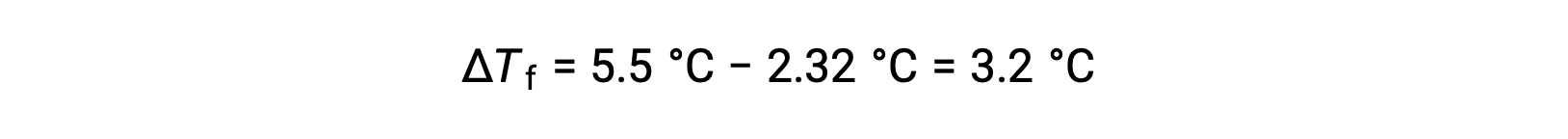
A continuación, la concentración molal se determina a partir de Kf, la constante de depresión del punto de congelación para el benceno, y ΔTf:
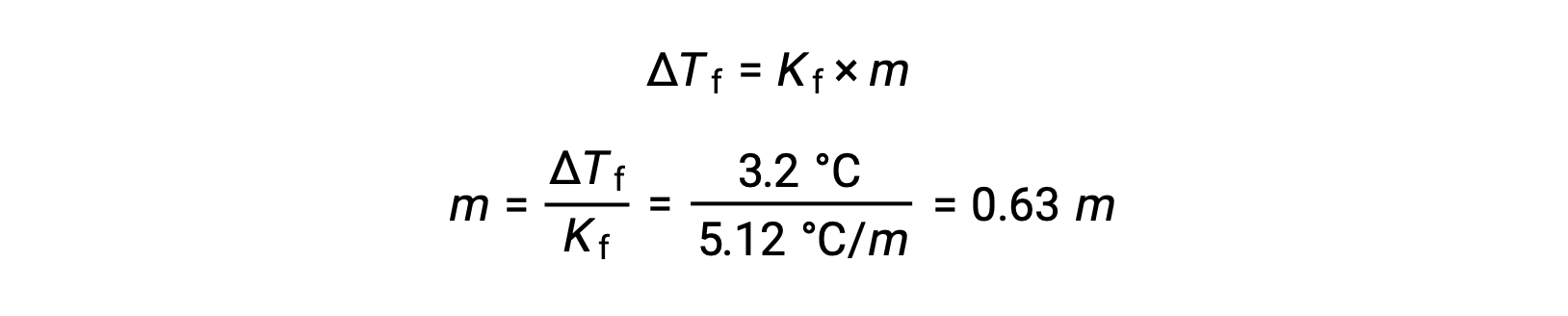
A continuación, el número de moles del compuesto en la solución se encuentra a partir de la concentración molal y la masa de disolvente que se utilizó para producir la solución.
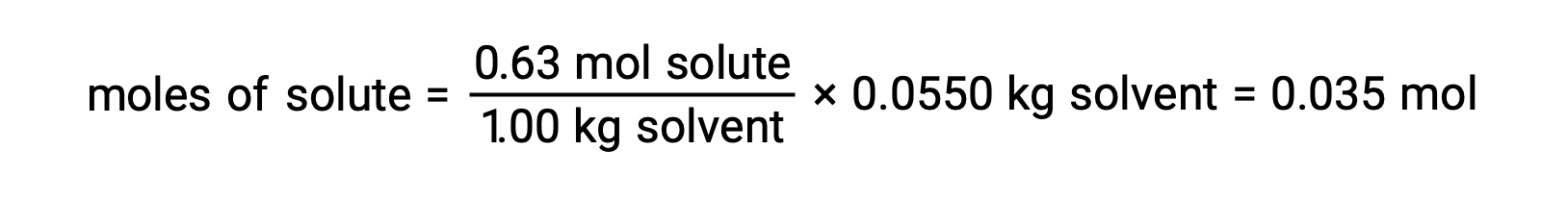
Y, finalmente, se determina la masa molar a partir de la masa del soluto y el número de moles en esa masa.
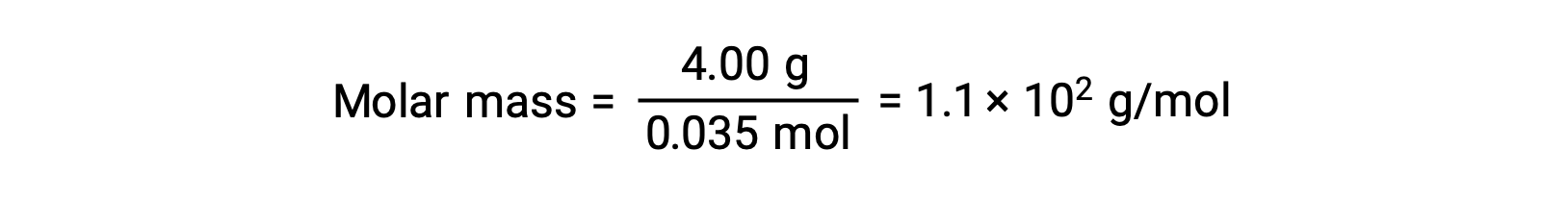
Este texto es adaptado de Openstax, Química 2e, Sección 11.4: Propiedades Coligativas.
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
