9.8:
键极性、偶极矩和离子性百分比
9.8:
键极性、偶极矩和离子性百分比
键极性
两个键合原子的电负性差异(ΔEN)的绝对值提供了键合中预期的极性的粗略量度,并因此提供了键合类型的粗略度量。当差异很小或为零时,键为共价键和非极性键。较大时,键为极性共价键或离子键。在键H,H,Cl和NaCl中原子之间的电负性差异的绝对值分别为0(非极性),0.9(极性共价)和2.1(离子性)。
原子之间电子共享的程度从完全相等(纯共价键)到根本不存在(离子键)。
- 例如,HF中的H和F原子的电负性差异为1.9,而NH 3 中的N和H原子的差异为0.9,但是这两个化合物形成的键为被认为是极性共价的。
- 同样,NaCl中的Na和Cl原子的电负性差异为2.1,而MnI 2 中的Mn和I原子的差异为1.0,但是这两种物质均形成离子化合物。
关于键的共价或离子特性的最佳指南是考虑所涉及原子的类型及其在元素周期表中的相对位置。
- 两种非金属之间的键通常是共价键。
- 金属与非金属之间的键合通常是离子性的。
某些化合物同时包含共价键和离子键。多原子离子中的原子,例如OH – ,NO 3 − , 和NH 4 + 通过极性共价键结合在一起。然而,这些多原子离子通过与相反电荷的离子结合而形成离子化合物。例如,硝酸钾KNO 3 包含K + 阳离子和多原子NO 3 − 阴离子。因此,硝酸钾中的键是离子性的,这是由于离子K + 与NO 3 &sups&s 之间的静电吸引以及共价键引起的。 3 − 中的氮和氧原子之间的关系。
分子极性和偶极矩
如前所述,极性共价键连接两个具有不同电负性的原子,使一个原子带有部分正电荷(δ+),而另一个原子带有部分负电荷(δ+),因为电子是拉向更具负电性的原子。电荷的这种分离引起键偶极矩。键偶极矩的大小由希腊字母mu(µ)表示,并由此处显示的公式给出,其中 Q 是部分电荷的大小(由电负性差异确定)和 r 是电荷之间的距离: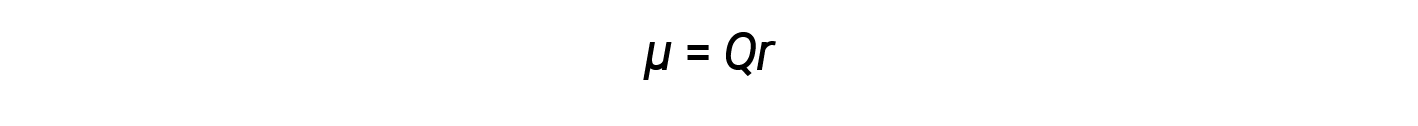
该键矩可以表示为矢量,该矢量既具有方向又具有大小。偶极子矢量显示为箭头,指向从负电性较弱的原子向负电性更高的原子的键。在负电性较低的一端绘制一个小加号,以表示该键的部分正端。箭头的长度与两个原子之间的电负性差异的大小成正比。
整个分子还可以具有电荷分离,这取决于其分子结构和每个键的极性。如果存在这种电荷分离,则该分子被称为极性分子(或偶极子);否则,该分子被认为是非极性的。偶极矩测量整个分子中净电荷分离的程度。偶极矩是在考虑到分子结构的基础上,通过将三维空间中的键矩相加而确定的。 对于双原子分子,只有一个键,因此它的键偶极矩决定了分子的极性。诸如Br 2 和N 2 的单核双原子分子的电负性没有差异,因此其偶极矩为零。对于诸如CO的异核分子,偶极矩很小。对于HF,由于电负性差异较大,所以偶极矩更大。当一个分子包含多个键时,必须考虑其几何形状。如果分子中的键排列成使得它们的键矩抵消(向量和等于零),则该分子是非极性的。这就是CO 2 中的情况。每个键都是极性的,但是分子整体上是非极性的。根据路易斯结构,并使用价层电子对互斥理论(VSEPR),确定CO 2 分子是线性的,在碳原子的相对侧具有极性C = O键。键矩抵消,因为它们指向相反的方向。在水分子的情况下,路易斯结构再次表明与中心原子存在两个键,电负性差异再次表明这些键中的每个键具有非零键矩。然而,在这种情况下,分子结构由于O上的孤对而弯曲,并且两个键矩不会抵消。因此,水确实具有净偶极矩,并且是极性分子(偶极子)。
