6.7:
热化学方程
大部分的化学反应发生在一大气压下。在这个恒压的环境下,与反应相关的热变化—delta Q,等于焓变delta H,也称为 反应中的焓或热。反应的焓是反应物及 生成物焓的变化量。当生成物的焓比 反应物的焓多,delta H 即为正值。这些的反应吸收热能且为吸热的。相反的,假使反应物的焓 比生成物的焓多,delta H即为负的。这些反应放出热能且为放热的。对于所有的化学反应,伴随的焓的大小决定于反 应物及生成 物的化学计量量,即为平衡方程式的系数。一个平衡方程式其 包含相位标签及焓(delta H)被称作热化学方程式。就甲烷的燃烧—主要的燃料成分。燃烧甲烷会释放热至周围环境。反应的放热性质在热 化学方程式中以负的 焓变化量表示。燃烧的反应指出当一 莫耳的甲烷与两莫耳的氧气反应,以产生一莫耳的二氧化碳及 两莫耳的液态水,和释出890.8千焦耳的 热至周遭环境中。反应物或生成物与热的 莫耳比例可以被用为转换的因 子而计算反应中所交换的热。假使一个汽缸装了25.5公斤的甲烷,且汽缸内全部的甲烷都燃烧了,试问多少会产出多少热?基本上,概念上是将质量转为 莫耳再将莫耳转换至反应热。首先,将25.5公斤乘以 1000以得到质量的公克数。接着,将甲烷的质量除以其莫耳质量 每莫耳16.0克,以得到1594莫耳的甲烷。最终,将甲烷的莫耳及反 应热以转换因子转换。1594莫耳的甲烷会释放 14.2乘以十至六千焦耳的热,其便是反应热。最终的答案会是负值,因为热在此反应中是放热反应。
6.7:
热化学方程
对于在恒定压力下进行的化学反应(系统)只做膨胀或收缩引起的工作–反应的焓(也称为反应热,Δ H rxn )等于与周围环境交换的热( q p )。
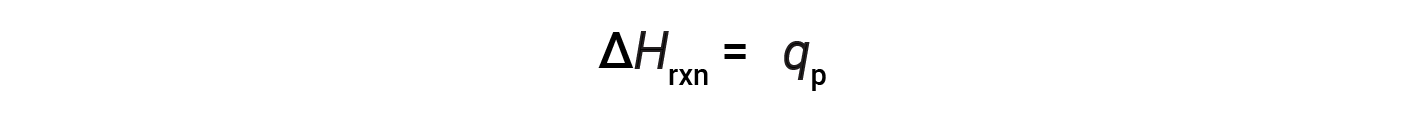
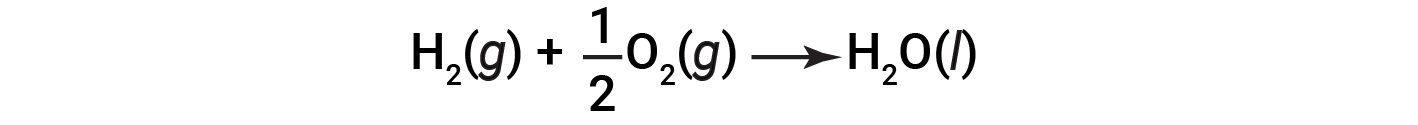
该方程式表明,向周围环境释放了286 kJ的热量。换句话说,对于消耗的每摩尔氢气或所产生的每摩尔水,释放出286 kJ的热量(反应是放热的)。因此,反应焓是一个转换因子,可用于计算在涉及特定量的反应物和产物的反应过程中释放或吸收的热量。
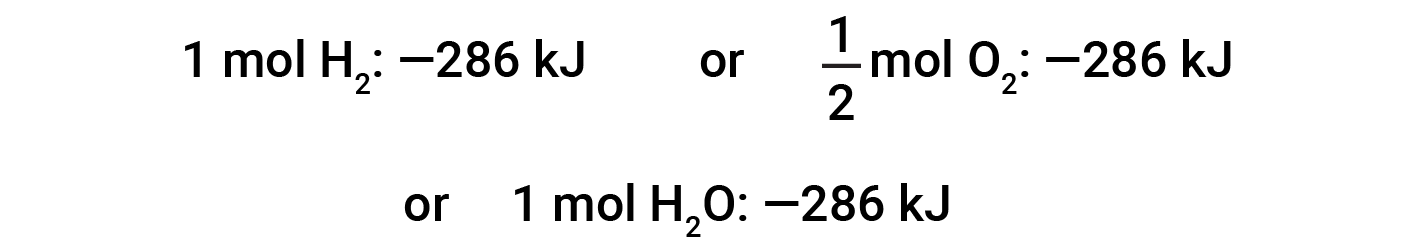
如果化学方程式的系数乘以某个因子(即,如果一种物质的量发生了变化),那么焓变必须乘以相同的因子。
(数量增加了两倍)
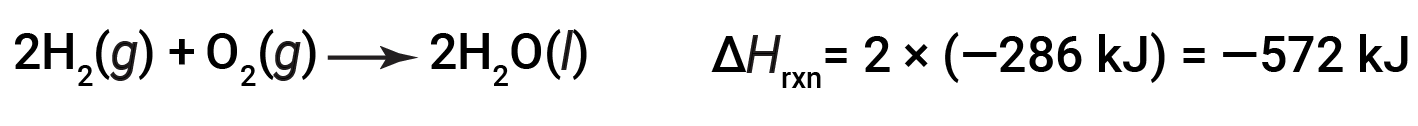
(数量减少了两倍)
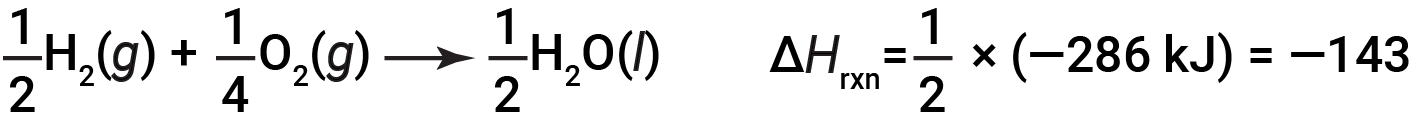
为说明反应的焓变取决于反应物和产物的物理状态,请考虑形成气态水(或水蒸气)。当1摩尔的氢气和 ½ 摩尔的氧气反应生成1摩尔的气态水,仅释放242 kJ的热量,而液态水形成时释放286 kJ的热量。
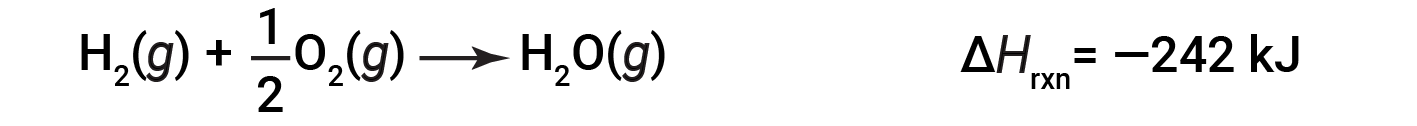
Suggested Reading
- Canagaratna, Sebastian G. "A visual aid in enthalpy calculations." Journal of Chemical Education 77, no. 9 (2000): 1178.
- Keifer, David. "Enthalpy and the Second Law of Thermodynamics." Journal of Chemical Education 96, no. 7 (2019): 1407-1411.
- Khalil, Mutasim I. "Calculating enthalpy of reaction by a matrix method." Journal of Chemical Education 77, no. 2 (2000): 185.
