6.5:
量化做功
系统的内能是被定义为 热及功的总和。而热是以热量计测量,但是是如何将其量化的呢?功是力所造成的结果,其当一个物体被 拉扯、推挤、或者举起一段距离。因此功等于力乘以距离。假设一个高尔夫球棍打中高尔夫球,并让其飞了 100英尺,高尔夫球棍便有做功。能量从球杆转换至球裡。在这个情况下,球是一个系统,而其功是表现在其周围环境中。在一个系统中的化学反应下,功可以与多种物理及化学改 变有所关联。一个普遍的功为压(力容)积功。一起来想想在引擎汽缸内的燃烧反应。燃烧反应不仅生成热,他更生成气体,其表现功。当气体体积在汽缸中膨胀,压力推将活塞向下推挤 并推挤外围的外部压力。压力被定义为作用在一个区域上的力。在此,来自膨胀气体的压力 分佈在活塞底部面积。换句而言,力是压力乘以面积。因此,当功其是力量乘以距离,也可以写作压力乘以面 积和所作用的距离。对于發动机汽缸,这是活塞移动的高度差。设面积乘以高度是汽缸的体积,那功的公式可被定义为压 力乘以系统内体 积的改变。然而,因为体积增加而活 塞被往下推挤,系统实际上是在对周围环境做功。按照惯例,这会是一个负值。因此,功被定义为 负值的压力P乘以 delta V 也就是膨胀前 后改变的体积,压积功的单位 通常定义为公升一标准大气压 这个单位可以转换成能量的常规单位,焦耳,以一公升一标准大气压等于 101.3焦耳做转换。
6.5:
量化做功
随着系统的变化,其内部能量也会发生变化,并且能量可以从系统传递到周围环境,或从周围环境传递到系统。
通过热和功进行能量传递。内部能量,热量和功之间的关系由以下方程式表示:
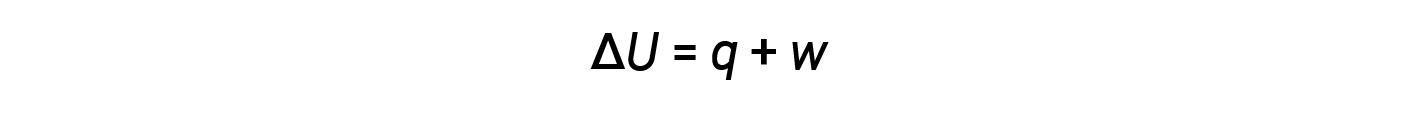
虽然热量是观察到的温度变化的函数,但是功是观察到的体积变化的函数,称为压力-体积功。功( w )可以定义为作用距离( D )的力( F )。
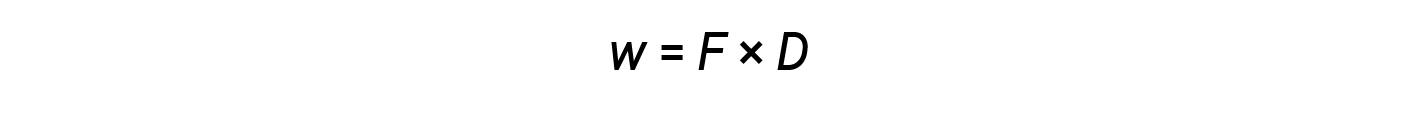
当系统克服约束压力将周围环境向后推时,或者当周围环境压缩系统时,就会发生压力-体积功(或膨胀功)。这样的一个例子在内燃机的运行中发生。汽油和氧气的燃烧反应是放热的。这些能量中的一部分以热量的形式散发出,有些通过做功使气缸中的气体膨胀,从而向外推动活塞。反应涉及的物质是系统,引擎和宇宙的其余部分是周围的环境。该系统通过加热和在周围环境中工作而损失能量,其内部能量减少。
当气缸的容积增加(即气体膨胀)时,它会抵抗外力,这是定义为每单位面积的力。
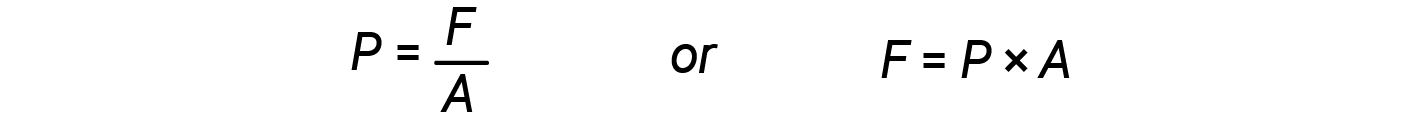
根据等式2和3:
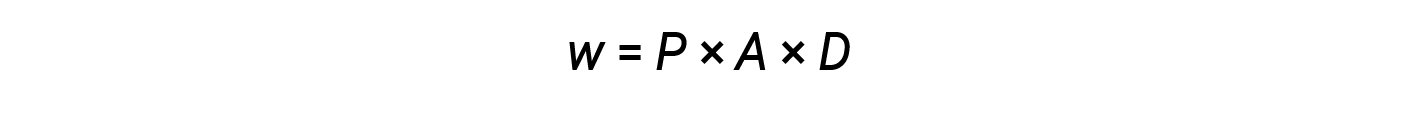
面积与距离的乘积( A × D )等于体积的变化量(Δ V )气瓶中的气体。
因此

由于在扩展过程中体积会增加,因此 V final > V initial ,而< V V 为正。但是,对于正扩展(即,当系统确实在环境中工作时), w 应该为负,因此,方程式中会添加负号。
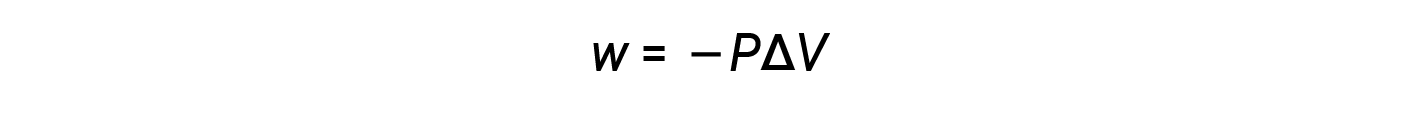
根据此等式,压力-体积功是外部压力(或反向压力)乘以体积变化的负值。
基于该等式的工作单位为L·atm。其他一些有用的转换因素是:
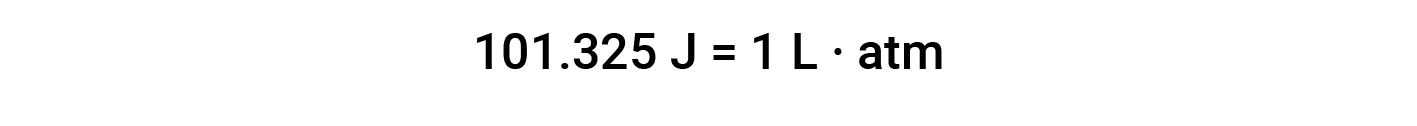
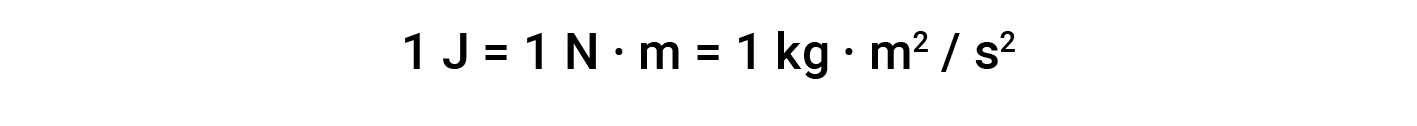
本文改编自 Openstax,化学2e,第5.3节:焓。
Suggested Reading
- Schmidt-Rohr, Klaus. "Expansion work without the external pressure and thermodynamics in terms of quasistatic irreversible processes." Journal of Chemical Education 91, no. 3 (2014): 402-409.
- Gislason, Eric A., and Norman C. Craig. "General definitions of work and heat in thermodynamic processes." Journal of Chemical Education 64, no. 8 (1987): 660.
- O'Loane, J. Kenneth. "Adiabatic changes: Reversible and irreversible changes involving only pressure-volume work." Journal of Chemical Education 30, no. 4 (1953): 190.
