4.10:
Reações de Oxidação-Redução
4.10:
Reações de Oxidação-Redução
Reações de Oxidação–Redução
A atmosfera terrestre contém cerca de 20% de oxigénio molecular, O2, um gás quimicamente reativo que desempenha um papel essencial no metabolismo dos organismos aeróbios e em muitos processos ambientais que moldam o mundo. O termo oxidação foi originalmente usado para descrever reações químicas envolvendo O2, mas o seu significado evoluiu para se referir a uma classe de reação ampla e importante conhecida como reações de oxidação–redução (redox).
Algumas reações redox envolvem a transferência de eletrões entre espécies de reagentes para produzir produtos iónicos, como a reação entre sódio e cloro para produzir cloreto de sódio:

É útil ver o processo em relação a cada reagente individual, ou seja, representar o destino de cada reagente na forma de uma equação chamada semi-reação:

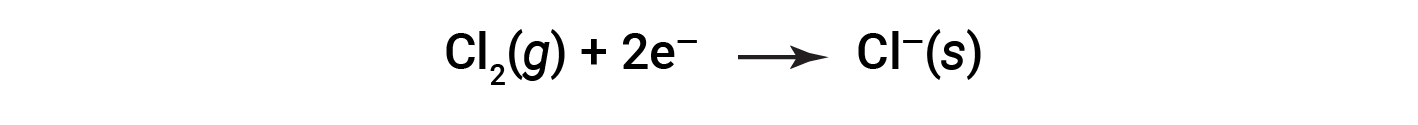
Estas equações mostram que os átomos de Na perdem eletrões enquanto que os átomos de Cl (na molécula Cl2) ganham eletrões, sendo que os subscritos “s” para os iões resultantes significam que estão presentes na forma de um composto iónico sólido. Para reações redox desse tipo, a perda e o ganho de eletrões definem os processos complementares que ocorrem:
oxidação = perda de eletrões
redução = ganho de eletrões
Nesta reação, o sódio é oxidado e o cloro sofre uma redução. Visto de uma perspectiva mais ativa, o sódio funciona como um agente redutor (redutor), uma vez que fornece eletrões ao cloro (ou reduz). Da mesma forma, o cloro funciona como um agente oxidante (oxidante), pois remove eficazmente os eletrões do sódio (oxida).
agente redutor = espécie que é oxidada
agente oxidante = espécie que é reduzida
No geral, um agente oxidante ganha um eletrão do agente redutor, e ele próprio é reduzido. A carga de um agente oxidante torna-se mais negativa. Da mesma forma, um agente redutor perde um eletrão para o agente oxidante, e ele próprio fica oxidado. A carga de um agente redutor torna-se mais positiva.
Alguns processos redox, no entanto, não envolvem a transferência de eletrões. Considere, por exemplo, uma reação semelhante à que produz NaCl:
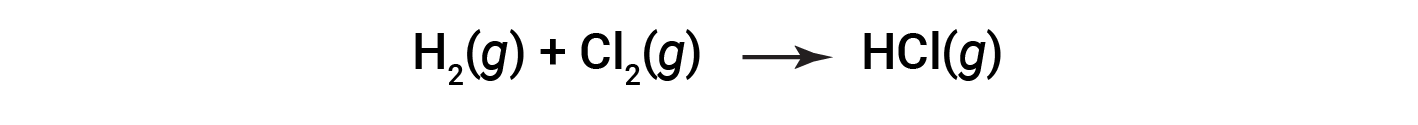
O produto desta reação é um composto covalente, portanto a transferência de eletrões no sentido explícito não está envolvida. Para clarificar a semelhança desta reação com a anterior e permitir uma definição inequívoca de reações redox, foi definida uma propriedade chamada número de oxidação.
Este texto é adaptado de Openstax, Chemistry 2e, Section 4.2: Classifying Chemical Reactions.
