4.3:
Rendimento das Reações
4.3:
Rendimento das Reações
O rendimento teórico de uma reação é a quantidade de produto que se estima ser formada com base na estequiometria da equação química equilibrada. O rendimento teórico assume a conversão completa do reagente limitante no produto desejado. A quantidade de produto que é obtida pela realização da reação é chamada de rendimento real, e pode ser menor que ou (muito raramente) igual ao rendimento teórico.
Rendimento Percentual
No caso de reações químicas, o rendimento real do produto é muitas vezes menor do que o rendimento teórico previsto com base na estequiometria da reação. Quando as reações são realizadas em um determinado conjunto de condições, espera-se uma perda inevitável de massa devido a várias razões. Algumas reações são naturalmente ineficientes, gerando outros produtos indesejáveis através de reações laterais. Outras são incompletas devido à sua natureza reversível, acompanhada por um estado de equilíbrio entre os reagentes e os produtos. Por vezes, a perda de massa do produto deve-se a uma recuperação inadequada do produto desejado da mistura da reação durante técnicas de purificação, tais como cristalização, destilação, filtração, e cromatografia. Nos casos em que ocorre perda de produto, a percentagem de rendimento é usada para medir a extensão em que o rendimento teórico de uma reação é alcançado.

Os rendimentos reais e teóricos podem ser expressos em massa ou em quantidades molares (ou qualquer outra propriedade apropriada, por exemplo, volume, se o produto for um gás). Desde que ambos os rendimentos sejam expressos utilizando as mesmas unidades, estas unidades serão canceladas quando a percentagem de rendimento for calculada.
Cálculo do Rendimento Percentual
Considere a combustão do óxido nítrico para dióxido de azoto.
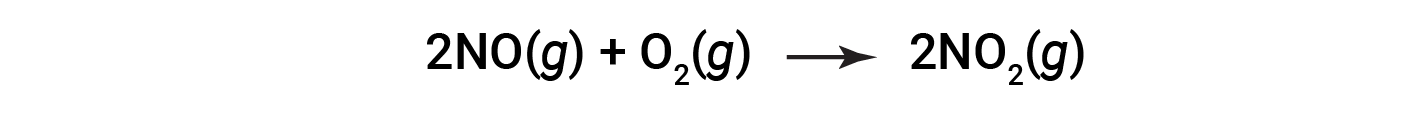
No final da reação, 180 gramas de dióxido de azoto são obtidos a partir de 150 gramas de óxido nítrico e de um excesso de oxigénio. Qual é o rendimento percentual?
O rendimento real da reação é de 180 gramas. Sabendo que o óxido nítrico é o reagente limitante, os moles de rendimento teórico são obtidos a partir da estequiometria de NO e NO2. Em primeiro lugar, a massa de NO é convertida em moles de NO. Em seguida, aplica-se a razão estequiométrica de NO:NO2 (1:1), que sugere que 5 moles de NO2 serão formados a partir de 5 moles de NO. Em terceiro lugar, os moles de NO2 são convertidos em massa.

No passo final, a percentagem de rendimento é calculada com base na relação entre o rendimento real e o rendimento teórico.

Este texto é adaptado de Openstax, Chemistry 2e, Section 4.4: Reaction Yields.
