17.6:
吉布斯自由能
É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
JoVE Core
Química
Gibbs Free Energy
28,631 Views
•
02:39 min
•
September 24, 2020
使用热力学第二定律来确定流程是否是自发的一个挑战是,它需要测量系统的熵变化和周围环境的熵变化。 十九世纪末,美国数学家乔西亚 · 威拉德 · 吉布斯推出了一种替代方法,该方法涉及仅以系统性质定义的新型热动力学属性。 这个新的属性被称为吉布斯自由能 (G) (或简称自由能) ,它在系统焓和熵中定义如下:
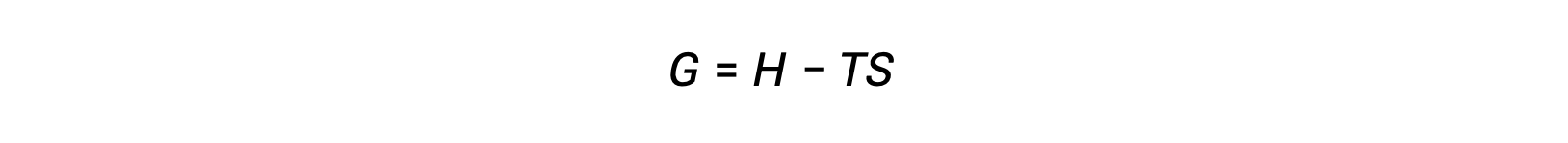
自由能是一种状态函数,在恒定的温度和压力下,自由能变化 (ΔG) 可以表示如下:
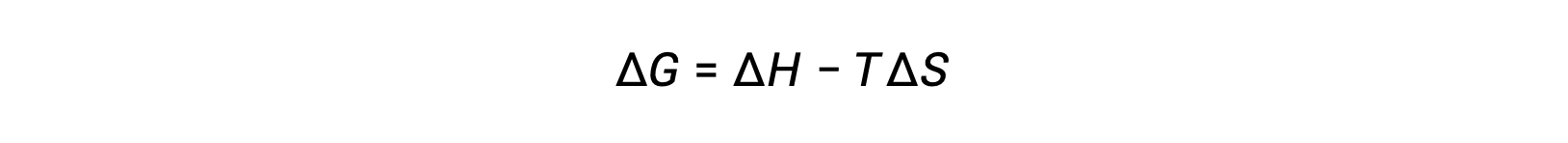
可以通过调用先前派生的第二个定律表达式来理解此系统属性与进程自发性之间的关系:
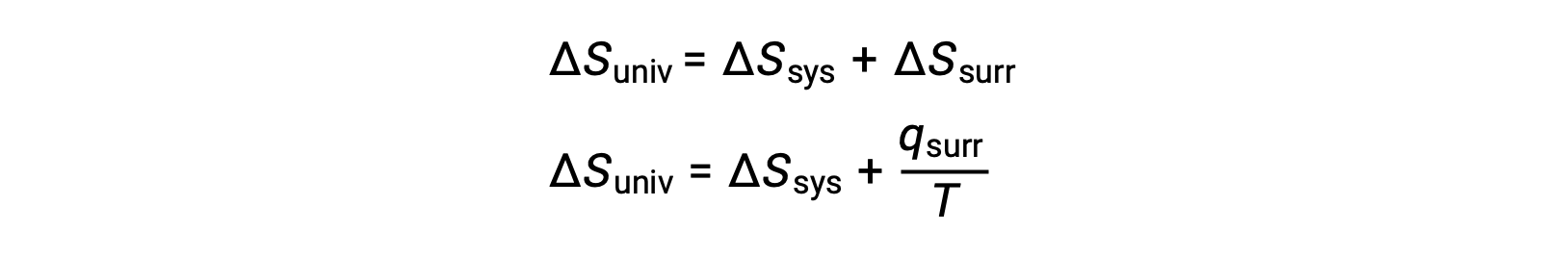
第一个定律要求 qsurr = −Qsys ,在恒压条件下 Qsys = ΔH ,因此该表达式可以改写为:
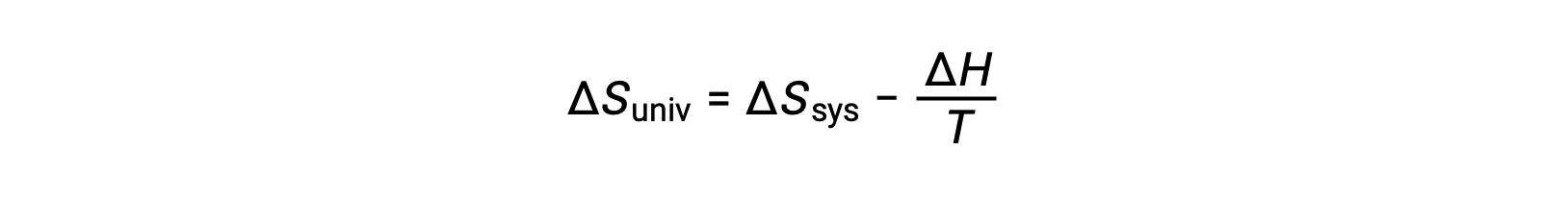
将该方程的两侧乘以 −T 并重新排列将产生以下结果:
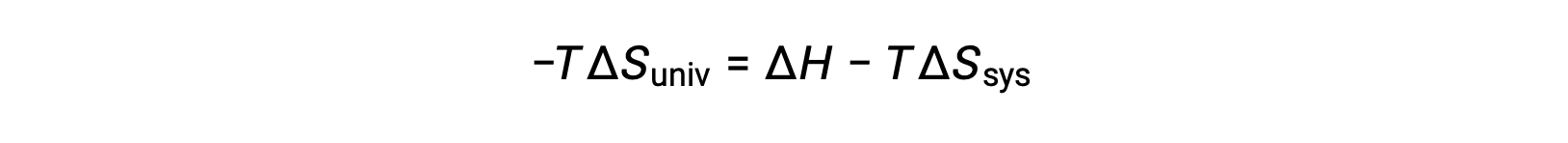
为了简单起见,可以省略下标“ sys ”,表达式将变为
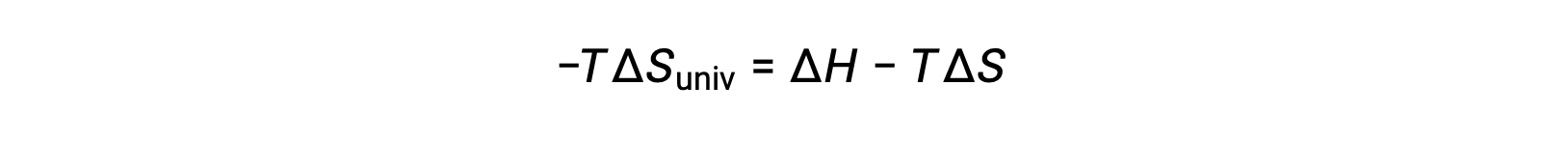
将此方程与上一个用于自由能更改的 进行比较时,将显示以下关系:
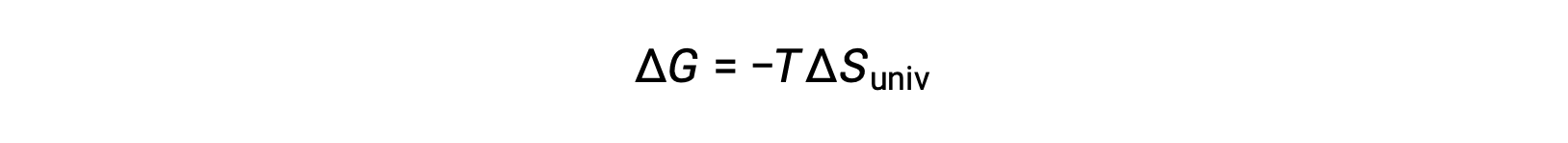
因此,自由能变化是一个可靠的过程自发性指标,因为它与先前确定的自发性指标 ΔSuniv 直接相关。
如果 ΔSuniv > 0 , ΔG < 0 ,则反应是自发的。
如果 ΔSuniv < 0 , ΔG > 0 且反应是非自发性的。
如果 ΔSuniv = 0 , ΔG = 0 且反应处于平衡状态。
本文改编自 Openstax, 化学 2e, 第16.4 章:自由能。
