14.1:
Динамическое равновесие
41,645 Views
•
•
Обратимая химическая реакция представляет собой химический процесс, который протекает как в прямом (слева направо), так и в обратном (справа налево) направлениях. Когда скорость реакции переднего и заднего хода равна, концентрации реагент и видов продукции остаются постоянными с течением времени и система находится в равновесии. Специальная двойная стрелка используется для того, чтобы подчеркнуть обратимое значение реакции. Относительные концентрации реагенты и продуктов в равновесных системах сильно различаются; некоторые системы содержат в основном продукты, которые находятся в равновесии, некоторые содержат в основном реагенты, а некоторые содержат значительные количества обоих.
Динамическое равновесие в химических реакциях
Рассмотрим обратимое разложение бесцветного тетрароксида динитрогена на выход бурного диоксида азота, описанного уравнением:
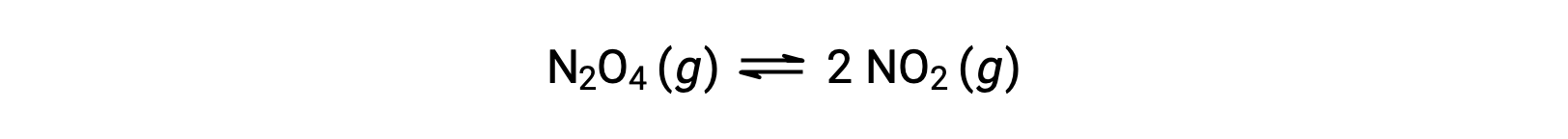
По мере начала реакции (время = 0) концентрация N2O4 реагент является конечной, а продукт NО2 равна нулю, поэтому реакция движения вперед продолжается с конечной скоростью, а скорость обратной реакции равна нулю. По мере прохождения времени N2O4 потребляется и его концентрация падает, при этом NО2 производится, и его концентрация увеличивается. Снижение концентрации реагент замедляет скорость реакции переднего хода, а увеличение концентрации продукта ускоряет скорость реакции заднего хода. Этот процесс продолжается до тех пор, пока скорость реакции переднего и заднего хода не станет равной, в это время реакция достигла равновесия. Важно подчеркнуть, что химическое равновесие является динамичным; реакция равновесия не “остановилась”, но идет в прямом и обратном направлениях с одинаковой скоростью. Таким образом, при равновесии концентрации N2O4 и NО2 больше не изменяются, так как скорость образования NО2 точно равна скорости потребления NО2, а скорость образования N2O4 точно равна скорости потребления N2O4.
Однородное и неоднородное равновесие
Однородное равновесие — это равновесие, в котором все реагенты и продукты (и любые катализаторы, если применимо) присутствуют на одной и той же фазе, водной или газообразной, как показано на следующих примерах:
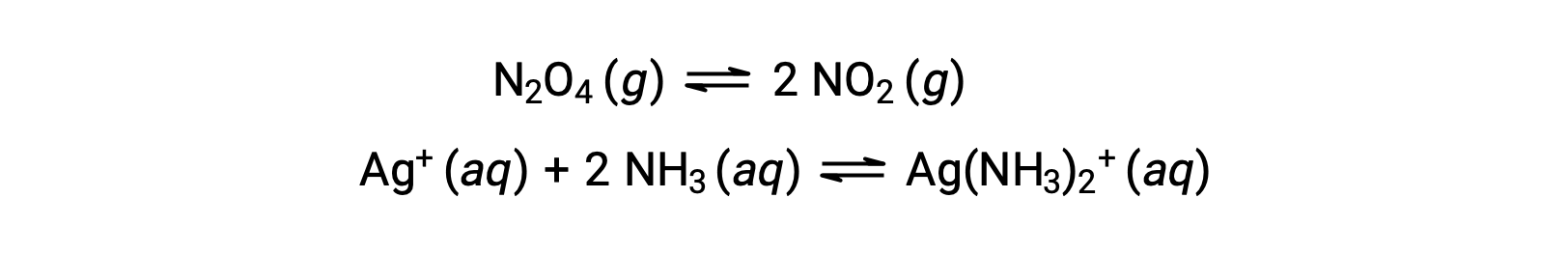
Гетерогенное равновесие включает в себя реагенты и продукты на двух или более разных этапах, как показано на следующем примере:
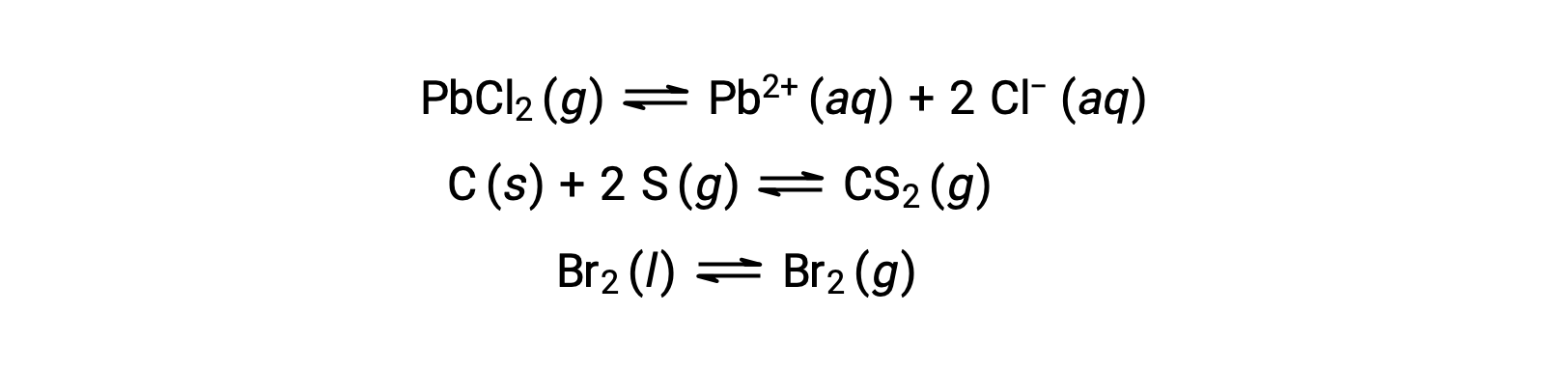
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 13.1 «Химическое равновесие».
