11.15:
分子性及びイオン性固体
11.15:
分子性及びイオン性固体
結晶性固体は、構成単位の種類と粒子間の相互作用によって、分子性、イオン性、金属性、共有結合性の4種類に分類されます。
分子性固体
氷、ショ糖(テーブルシュガー)、ヨウ素などの分子性結晶固体は、中性の分子を構成単位とする固体です。これらの分子は、ロンドン分散力、双極子-双極子相互作用、水素結合などの弱い分子間力によって結合しており、これらの力がその性質を決定しています。(Table 1)
結晶によって存在するユニット間の引力の強さは大きく異なり、それが結晶の融点に反映されています。
• H2、N2、O2、F2などの小さな対称的な非極性分子は分散力が弱く、非常に低い融点( −200 °C以下)の分子固体を形成します。
また、より大きな非極性分子からなる物質は、より大きな吸引力を持ち、より高い温度で溶解します。
• 永久双極子モーメントを持つ極性分子で構成される分子固体は、さらに高い温度で融解します。例えば、固体のSO2やテーブルシュガーなどです。凍った水や氷に見られるように、このような分子性固体の3次元的な格子を維持するためには、主に分子間の水素結合が必要です。
分子固体の特性は、構成単位である分子の三次元的な効率的な充填に依存しています。分子間力は接触に依存しているため、構成分子の対称性が高ければ高い分子間引力で結晶構造内に緊密に充填されます。これにより、融点が上昇します。分子の対称性が低い場合は、効率的な充填ができません。
イオン性固体
塩化ナトリウムのようなイオン性の結晶性固体は、正と負のイオンが強い静電引力で結合しています。
イオン性固体は、強いイオンの引力のために高い融点を有します。イオン性固体中の陽イオンと陰イオンの間のイオン相互作用の強さは、クーロンの法則で与えられる静電力で近似できます。
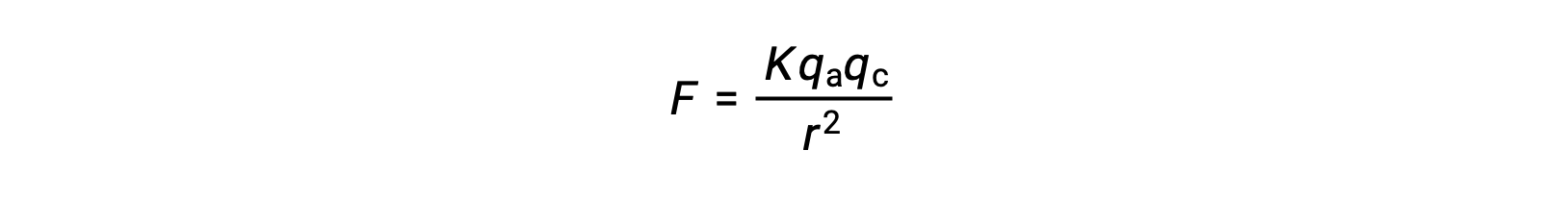
ここで、Kは比例定数、rは電荷間の距離、qaとqcはそれぞれ陰イオンと陽イオンの電荷を表しています。陰イオンと陽イオンの電荷が大きいほど、イオンの引力は強くなります。同様に、陰イオンと陽イオンが結晶格子に緊密に充填されていると、電荷間の距離が短くなり、イオン同士の引力が強くなります。
イオン性固体は硬い反面、脆い傾向があり、曲がることなく砕けてしまいます。その脆さの原因は、結晶格子の中に引力(陰イオンと陽イオン)と斥力(陽イオン–陽イオンと陰イオン–陰イオン)の両方の相互作用が存在することです。イオンは強いクーロン力のために自由に動くことができないので、イオン性固体は電気を通しません。
Table 1. 分子性固体とイオン性固体の特徴
| 結晶性固体の種類 | 構成する粒子の種類 | 特徴の種類 | 性質 | 例 |
| 分子性固体 | 分子 | 分子間力(IMF):分散力、双極子-双極子力、水素結合 | 硬度、脆性、融点が低く、熱と電気の伝導が悪い | Ar、H 2 O(氷)、CO 2 (ドライアイス)、I 2 、C 12 H 22 O 11 (ショ糖) |
| イオン性固体 | イオン | 静電 | 硬く、もろく、高融点。溶融および溶解状態では電気伝導体 | NaCl(テーブルソルト)、 MgO(酸化マグネシウム)、 Al 2 O 3 (アルミナ) |
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 10.5:The Solid State of Matter.
