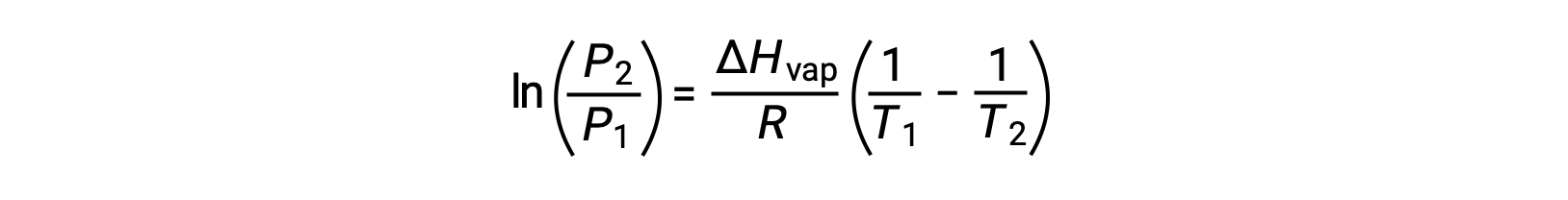11.9:
클라우지우스-클라페롱 식
É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
JoVE Core
Química
Clausius-Clapeyron Equation
49,029 Views
•
02:35 min
•
September 24, 2020
액체와 증기 사이의 평형은 시스템의 온도에 따라 달라집니다. 온도의 상승은 액체의 증기 압력에 대응하는 상승을 야기한다. 클라우스-클랩페이론 방정식은 물질의 증기압력(P)과온도(T)사이의 정량적 관계를 제공합니다. 단위당 증기 압력이 증가하는 온도가 예측됩니다.
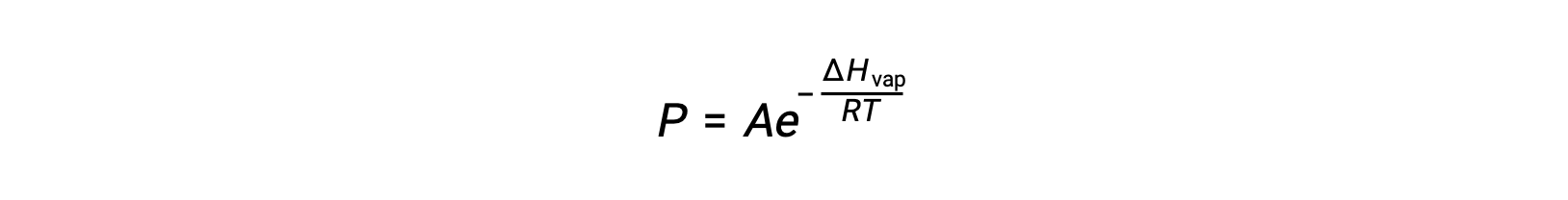
ΔH증기가 액체에 대한 기화의 엔탈피인 경우, R은 가스 상수이며, A는 물질의 화학적 정체성에 따라 값이 일정한 다. 온도(T)는이방정식에서 켈빈에 있어야합니다. 그러나 증기 압력과 온도 간의 관계가 선형이 아니기 때문에 방정식은 선형 방정식을 산출하기 위해 로그리지믹 형태로 재배열되는 경우가 많습니다.
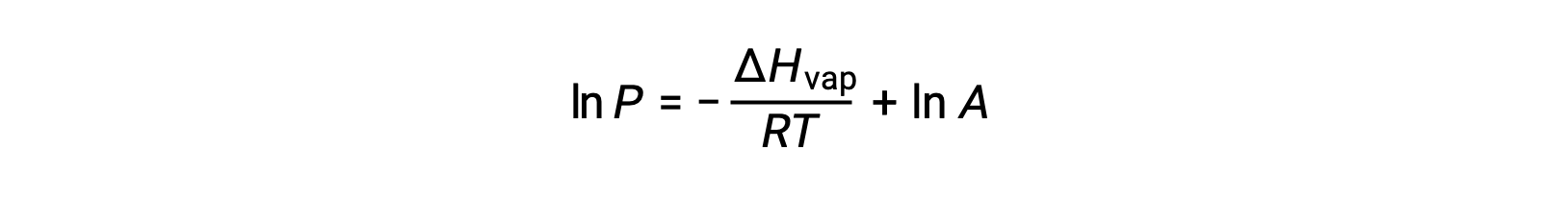
어떤 액체의 경우, 특정 온도에서 기화 및 증기 압력의 엔탈피가 알려지면 클라우시우스-클랩페이론 방정식은 다른 온도에서 액체의 증기 압력을 결정할 수 있게 한다. 이렇게 하려면 선형 방정식이 2점 형식으로 표현될 수 있습니다. 온도 T1에서증기 압력은 P1이고온도 T2에서증기 압력은 P2이며,해당 선형 방정식은 다음과 같습니다.
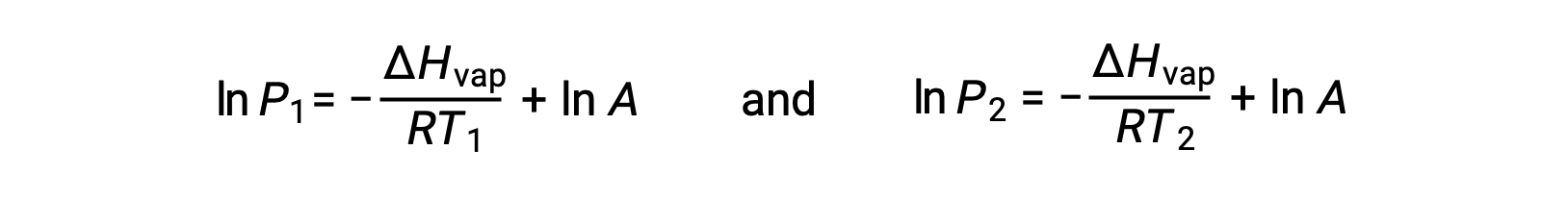
상수 A는동일하므로 이 두 방정식은 ln A를 격리한 다음 서로 동일하게 설정하도록 재배열될 수 있습니다.
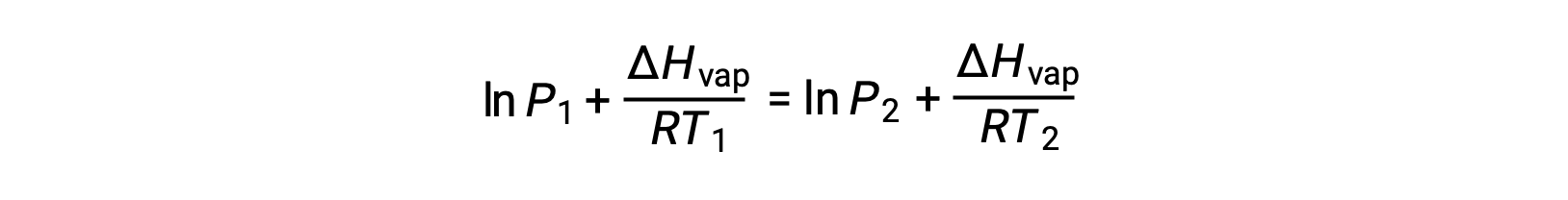
결합할 수 있는 것: