11.9:
معادلة كلاوزيوس-كلايبرون
49,028 Views
•
•
يعتمد التوازن بين السائل وبخاره على درجة حرارة النظام؛ يؤدي ارتفاع درجة الحرارة إلى ارتفاع مماثل في ضغط بخار سائله. تعطي معادلة كلاوزيوس-كلابيرون العلاقة الكمية بين المادة’ s ضغط البخار (P) ودرجة حرارته (T)؛ فهو يتوقع معدل زيادة ضغط البخار لكل وحدة زيادة في درجة الحرارة.
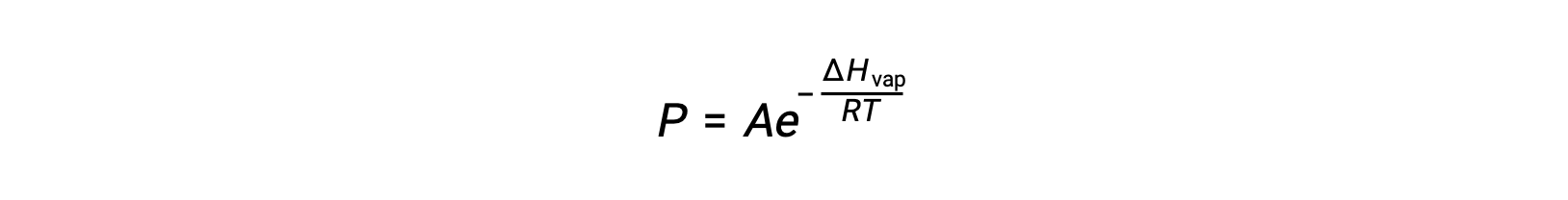
حيث يمثل ΔHvap المحتوى الحراري لتبخير السائل، و R هو ثابت الغاز، و A ثابت تعتمد قيمته على الهوية الكيميائية للمادة. يجب أن تكون درجة الحرارة (T) بوحدة كلفن في هذه المعادلة. ومع ذلك، نظرًا لأن العلاقة بين ضغط البخار ودرجة الحرارة ليست خطية، غالباً ما يتم إعادة ترتيب المعادلة في شكل لوغاريتمي للحصول على المعادلة الخطية:
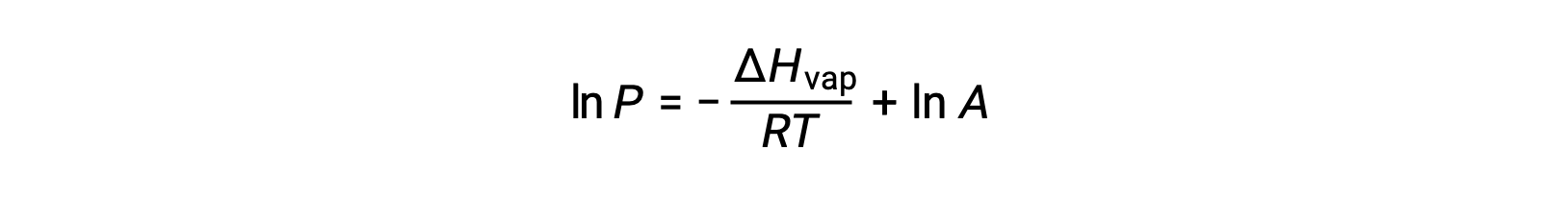
بالنسبة لأي سائل، إذا كان المحتوى الحراري للتبخر وضغط البخار عند درجة حرارة معينة معروفًا، فإن معادلة كلاوزيوس-كلابيرون تسمح بتحديد ضغط بخار السائل عند درجة حرارة مختلفة. للقيام بذلك، يمكن التعبير عن المعادلة الخطية بتنسيق من نقطتين. إذا كانت درجة الحرارة T1 ، يكون ضغط البخار P1، وعند درجة الحرارة T2، ضغط البخار هو P2، والمعادلات الخطية المقابلة هي:
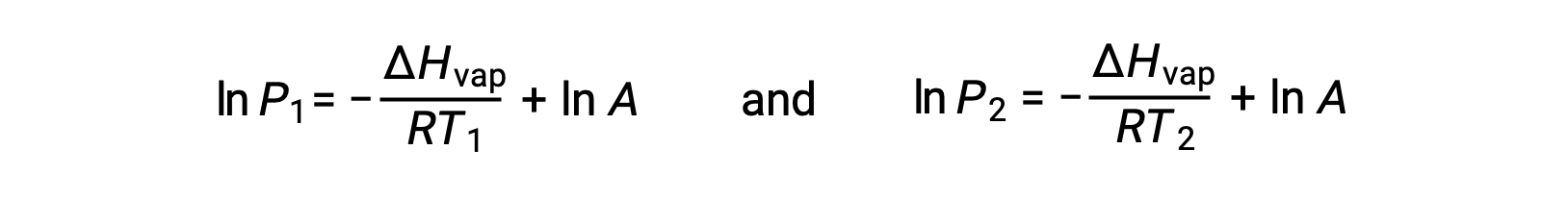
نظراً لأن الثابت A هو نفسه، يمكن إعادة ترتيب هاتين المعادلتين لعزل lnA ثم جعلهما متساويين:
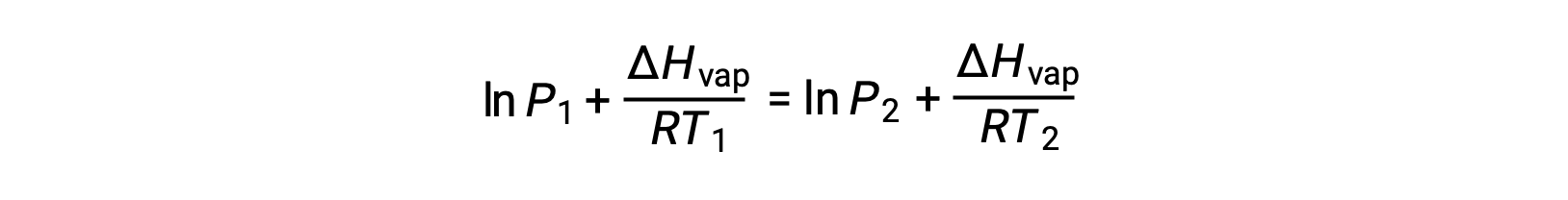
والتي يمكن دمجها في:
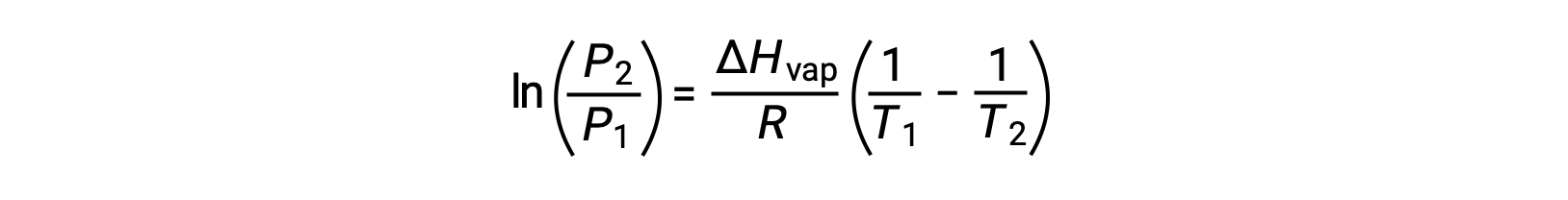
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
