18.1:
Балансировка окислительно-восстановительных уравнений
43,088 Views
•
•
Электрохимия — это наука, участвующее в преобразовании электрических и химических реакций. Такие реакции называются восстановительно-окислительной или окислительно-восстановительной реакцией. Эти важные реакции определяются изменениями в окислительных состояниях одного или нескольких элементов реагент и включают в себя подмножество реакций, связанных с передачей электронов между видами реагент. Электрохимия как область развития стала давать достаточно информации об основных принципах химии редокс и множественных технологиях, начиная от промышленных металлургических процессов и заканчивая надежными перезаряжаемыми батареями для электромобилей. Поскольку реакции, связанные с передачей электронов, имеют важное значение для изучения электрохимии, краткий обзор химии редокс включает следующее.
Окисление
По определению, окислительно-восстановительная реакция включает изменение либо окислительного числа, либо состояния окисления для одного или нескольких реагенты. Окислительный номер элемента — это оценка того, как электронная среда его атомов отличается от атомов чистого элемента. По этому определению атом в элементе имеет нулевое окисление. Для атома окислительный номер равен заряду атома в соединении, если соединение было ионным. Таким образом, сумма чисел окисления для всех атомов в молекуле равна заряду молекулы.
Ионные соединения
Простые ионные соединения являются простейшими примерами этого формализма, так как элементы имеют окислительные числа, равные их ионным зарядам. Хлорид натрия, NaCl, состоит из катионов Na+ и Cl– анионов, при этом окисление натрия и хлора составляет +1 и -1 соответственно. 1. Фторид кальция, CaF2, состоит из катионов Ca2+ и ионов F– с окислением кальция и фтора, +2, и -1.
Ковалентные соединения
Ковалентные соединения более сложны в использовании формализма. Вода представляет собой ковалентное соединение, состоящее из двух атомов H, связанных с атомом O через полярные ковалентные связи O-H. Общие электроны, делающие O-H связь, более сильно притягиваются к более электрикативному атому O. Таким образом, кислород приобретает частичный отрицательный заряд по сравнению с атомом O в элементном кислороде. В результате атомы H в молекуле воды демонстрируют частичный положительный заряд по сравнению с атомами водорода в газообразном водороде. Сумма частичных отрицательных и положительных зарядов для каждой молекулы воды равна нулю, что делает молекулу воды нейтральной.
Если поляризация общих электронов в молекунах O-H воды будет завершена, результатом будет полная передача электронов от H к O, а вода будет ионным соединением, состоящим из анионов O2 и H+ катионов. Таким образом, количество окислов кислорода и водорода в воде составляет 2 и 1, соответственно. Применение этой же логики к тетрахлорметану, CCl4, приводит к окислению +4 для углерода и -1 для хлора. В ионе нитратов NО3– окисление азота составляет +5, а для кислорода — -2, суммируя для молекулы заряд -2 1:
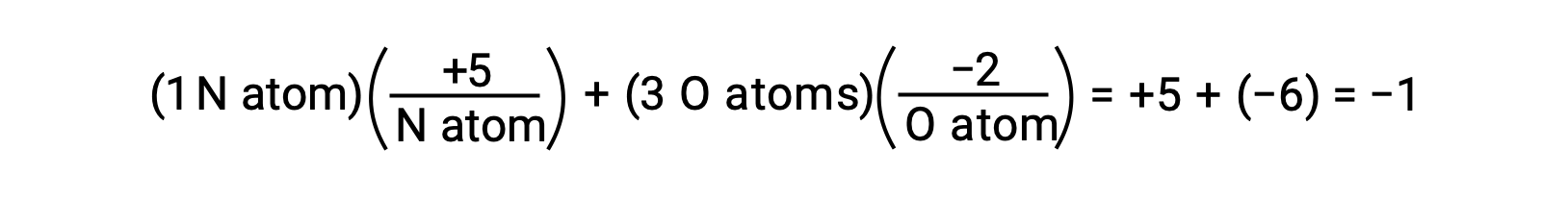
Балансирование редокс-уравнений
Несбалансированное уравнение, приведенное ниже, описывает разложение хлорида натрия:
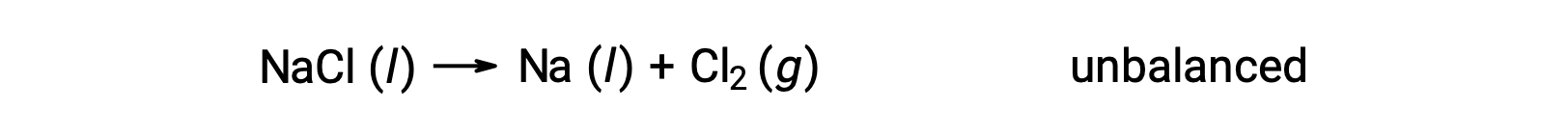
Эта реакция соответствует критерию окислительно-восстановительной реакции, так как окисление Na уменьшается с +1 до 0 (за счет снижения) и что для CL увеличивается с 1 до 0 (за счет окисления). Случай уравнения легко сбалансирован путем добавления стехиометрического коэффициента 2 для NaCl и Na:
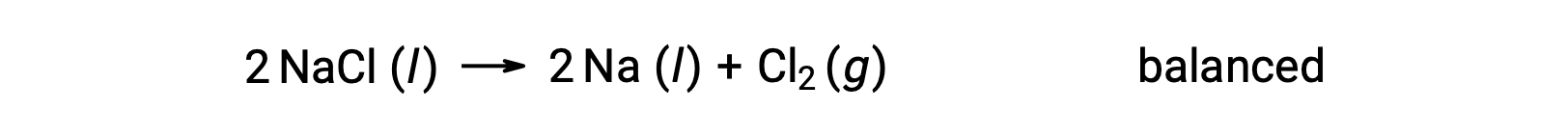
Окислительно-восстановительные реакции, возникающие в водных растворах, обычно встречаются в электрохимии, и многие из них включают воду или ее ионы, H+ (aq) и OH– (aq), как реагенты или продукты.
В этих случаях уравнения, представляющие окислительные реакции, могут быть очень сложными для балансировки только путем осмотра, и использование систематического подхода, известного как метод полуреакции, полезно. Этот подход включает в себя следующие шаги:
- Разделите уравнение на его компонент, окисление скелета и половинные реакции восстановления.
- Сбалансируйте каждую половинную реакцию для всех элементов, кроме O и H.
- Сбалансируйте каждую половинную реакцию атомов O, добавив молекулы воды по мере необходимости в уравнение.
- Сбалансируйте каждую половинную реакцию атомов H, добавив протоны в соответствии с требованиями уравнения.
- Наконец, сбалансируйте заряды на элементах, добавляя электроны по мере необходимости.
- Умножьте полуреакции на любое целое число, необходимое для выравнивания количества электронов, потерянных в окислительной полуреакции, на количество электронов, полученных в результате уменьшения полуреакции.
- Добавьте обе половинные реакции и упростите их, отменив общие виды с обеих сторон уравнения.
- Если реакция происходит в щелочной среде, добавьте ионы OH в уравнение, полученное на шаге 7, чтобы нейтрализовать протоны (добавленные равными числами к обеим сторонам уравнения) и упростить.
- Проверьте уравнение, чтобы убедиться, что заряды атомов сбалансированы.
Этот текст адаптирован к Openstax, Химия 2е изд., Chapter 17: Введение, и Openstax, Химия 2е изд., Раздел 17.2: Обзор химического состава редокс.
