18.1:
酸化還元反応の平衡
43,086 Views
•
•
電気化学とは、電気反応と化学反応の相互変換に関する科学です。このような反応は、「還元-酸化」または「酸化還元反応」と呼ばれます。これらの反応は、1つまたは複数の反応要素の酸化状態の変化によって定義され、反応種間の電子の移動を伴う半反応(の部分集合)も含まれます。電気化学は、酸化還元化学の基本原理や、工業規模の冶金プロセスから電気自動車用の堅牢な二次電池まで、さまざまな技術について十分な知見が得られる分野として発展してきた。電子の移動を伴う反応は電気化学の根幹であり、酸化還元化学を理解するためのいくつかの要素を以下で述べます。
酸化数
酸化還元反応とは、1つまたは複数の反応物の酸化状態が変化する反応として定義されます。元素の酸化数とは、純粋な元素の原子と比較して、その原子の電子環境がどのように異なるかを評価したものです。この定義によれば、元素中の原子の酸化数は0です。原子の酸化数は、その化合物がイオンである場合の原子の電荷に等しいです。したがって、分子内のすべての原子の酸化数の合計は、その分子の電荷と同じになります。
イオン性化合物
単純なイオン性化合物は、元素がイオン電荷と等しい酸化数を持つため、形式酸化数を考える上で最も単純な例です。塩化ナトリウム(NaCl)は、Na+の陽イオンとCl−の陰イオンで構成され、ナトリウムと塩素の酸化数はそれぞれ+1と −1です。フッ化カルシウム(CaF2)は、Ca2+陽イオンとF−陰イオンからなり、カルシウムとフッ素の酸化数は、それぞれ+2と −1です。
共有結合性化合物
共有結合を持つ化合物は、形式酸化数を考える上でより困難です。水は、2つの水素原子と1つの酸素原子が極性共有結合で結合した共有結合化合物です。O−H結合を作っている共有電子は、より電気陰性のO原子に強く引き付けられます。そのため、酸素は単体の酸素に比べて部分的に負の電荷を帯びています。その結果、水分子中の水素原子は、水素ガス中の水素原子に比べて部分的にプラスの電荷を持つことになります。水分子の部分的な負電荷と正電荷の合計はゼロとなり、水分子は中性となります。
もし、水のO−H結合内における共有電子の分極が非常に極端であると仮定すると、HからOへと電子が完全に移動し、水はO2−陰イオンとH+陽イオンからなるイオン化合物となります。そして、水の中の酸素と水素の酸化数は、それぞれ −2 と +1 です。これと同じ理屈を四塩化炭素(CCl4)に当てはめると、炭素の酸化数は+4、塩素の酸化数は −1となります。硝酸イオン(NO3−)では、窒素の酸化数は+5、酸素の酸化数は−2で、合計すると分子の電荷は−1になります。
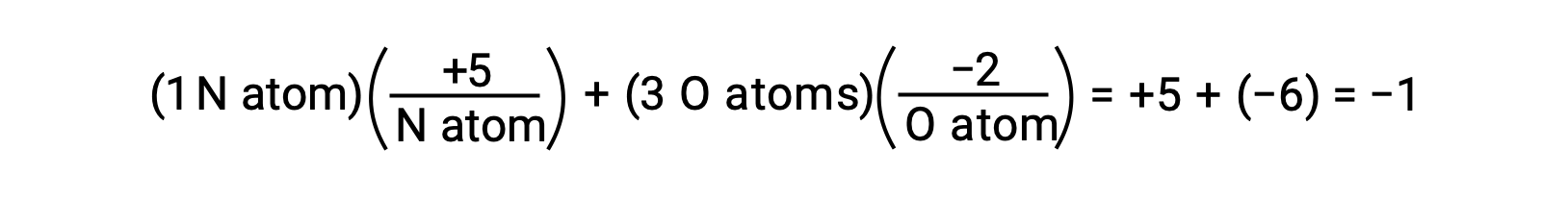
酸化還元反応における係数の決定
以下の原子数が釣り合わない式は、塩化ナトリウムの分解を表しています。
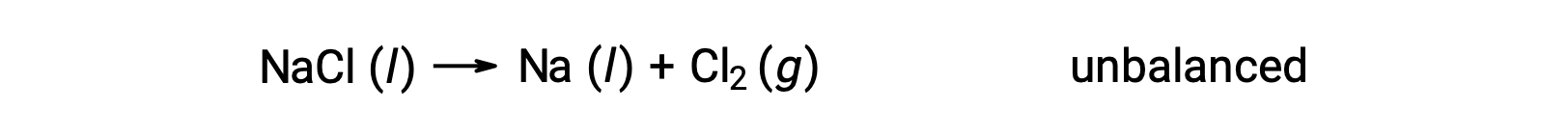
この反応は、Naの酸化数が+1から0に減少し(還元が進行)、Clの酸化数が −1から0に増加する(酸化が進行)ことから、酸化還元反応の定義に合致しています。この方程式の場合は、NaClとNaの化学量論的係数2を加えることで簡単に原子数のつり合いが取れます。
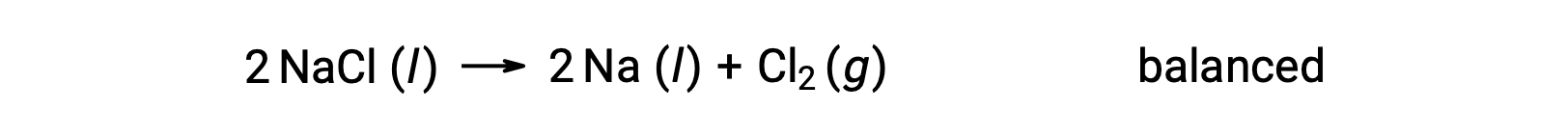
水溶液中で起こる酸化還元反応は、電気化学の分野ではよく見られる現象であり、多くは水やそのイオンであるH+ (aq)やOH−(aq)が反応物や生成物として関与しています。
このような場合、酸化還元反応を表す方程式を見ただけで両辺の原子数を釣り合わせることが非常に困難であり、半反応法と呼ばれる体系的なアプローチが有用です。この方法は次のようなステップで進めます。
- この式を、構成している酸化および還元の半反応にそれぞれ分割します。
- OとH以外のすべての元素について、各半反応の原子数を釣り合わせます。
- 式の中で必要に応じて水分子を加え、O原子が含む各半反応の原子数を釣り合わせます。
- 式に必要な水素イオンを加えて、H原子を含む各半反応の原子数を釣り合わせます。
- 最後に、必要に応じて電子を追加して元素の電荷を釣り合わせます。
- 酸化の半反応で失われる電子の数と還元の半反応で得られる電子の数を等しくするために、半反応に適切な数を掛けます。
- 両方の半反応を加え、式の両辺にある共通の化学種を消去することで式を単純化します。
- 塩基性溶液で反応が起こる場合、手順7で得られた式にOH−イオンを加えて水素イオンを中和し(式の両辺に同数ずつ加える)、簡略化します。
- 式を確認し、原子の電荷が釣り合っていることを確認します。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Chapter 17: Introduction, and Openstax, Chemistry 2e, Section17.2: Review of Redox Chemistry.
