18.1:
Équilibrer une réaction d'oxydoréduction
43,088 Views
•
•
L’électrochimie est la science impliquée dans l’interconversion des réactions électriques et chimiques. De telles réactions sont appelées réactions d’oxydoréduction, ou réactions redox. Ces réactions importantes sont définies par des changements de l’état d’oxydation d’un ou de plusieurs éléments réactifs et comprennent un sous-ensemble de réactions impliquant le transfert d’électrons entre les espèces de réactifs. L’électrochimie en tant que domaine a évolué pour donner suffisamment d’informations sur les principes fondamentaux de la chimie redox et de multiples technologies allant des procédés métallurgiques à l’échelle industrielle aux batteries robustes et rechargeables pour les véhicules électriques. Comme les réactions impliquant le transfert d’électrons sont essentielles à l’étude de l’électrochimie, un bref récapitulatif de la chimie redox comprend ce qui suit.
Nombre d’oxydation
Par définition, une réaction d’oxydoréduction implique un changement du nombre d’oxydation ou du degré d’oxydation d’un ou plusieurs réactifs. Le nombre d’oxydation d’un élément est une évaluation de la façon dont l’environnement électronique de ses atomes diffère par rapport aux atomes de l’élément pur. D’après cette définition, un atome dans un élément porte un nombre d’oxydation de zéro. Pour un atome, le nombre d’oxydation est égal à la charge de l’atome dans le composé si le composé est ionique. Ainsi, la somme des nombres d’oxydation de tous les atomes d’une molécule est égale à la charge de la molécule.
Composés ioniques
Les composés ioniques simples sont les exemples les plus simples de ce formalisme puisque les éléments ont des nombres d’oxydation égaux à leurs charges ioniques. Le chlorure de sodium, NaCl, est composé de cations Na+ et d’anions Cl−, les nombres d’oxydation pour le sodium et le chlore étant respectivement +1 et −1. Le fluorure de calcium, CaF2, est composé de cations Ca2+ et d’anions F−, avec des nombres d’oxydation pour le calcium et le fluor de +2 et −1.
Composés covalents
Les composés covalents sont plus compliqués en ce qui concerne l’utilisation du formalisme. L’eau est un composé covalent constitué de deux atomes H liés à un atome O via des liaisons O−H covalentes polarisées. Les électrons communs qui forment une liaison O−H sont plus fortement attirés par l’atome O plus électronégatif. Ainsi, l’oxygène acquiert une charge partielle négative, par rapport à un atome O de l’oxygène élémentaire. Par conséquent, les atomes H d’une molécule d’eau présentent une charge partielle positive par rapport aux atomes d’hydrogène du gaz hydrogène. La somme des charges partielles négatives et positives pour chaque molécule d’eau est nulle, ce qui rend la molécule d’eau neutre.
Si la polarisation des électrons communs à l’intérieur des liaisons O−H de l’eau était complète, le résultat serait le transfert total des électrons de H à O, et l’eau serait un composé ionique composé d’anions O2− et de cations H+. Ainsi, les nombres d’oxydations de l’oxygène et de l’hydrogène dans l’eau sont respectivement −2 et +1. En appliquant cette même logique au tétrachlorure de carbone, CCl4, cela donne des nombres d’oxydation de +4 pour le carbone et de −1 pour le chlore. Dans l’ion nitrate NO3−, le nombre d’oxydation est de +5 pour l’azote et celui de l’oxygène est de −2, ce qui s’additionne pour être égal à la charge de −1 sur la molécule :
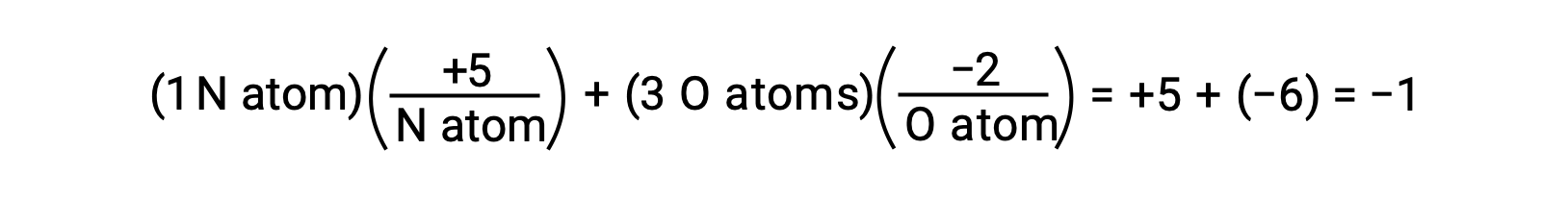
Equilibrer des équations redox
L’équation déséquilibrée ci-dessous décrit la décomposition du chlorure de sodium :
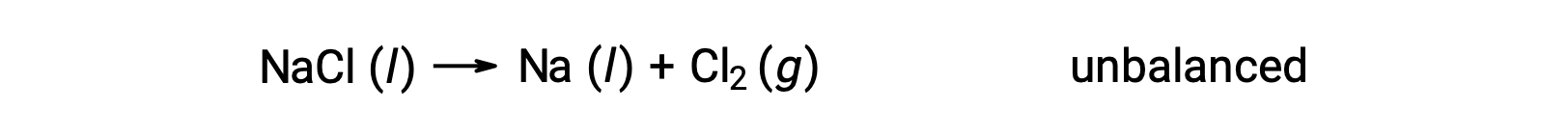
Cette réaction correspond au critère d’une réaction d’oxydoréduction, car le nombre d’oxydation du Na diminue de +1 à 0 (en subissant une réduction) et celui du Cl augmente de −1 à 0 (en subissant une oxydation). Le cas de cette équation est facilement équilibré en ajoutant le coefficient stœchiométrique de 2 pour le NaCl et Na :
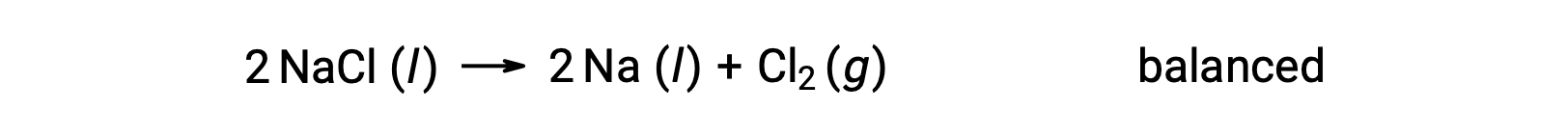
Les réactions d’oxydoréduction qui se produisent en solutions aqueuses se rencontrent couramment en électrochimie, et beaucoup impliquent l’eau ou ses ions, H+ (aq) et OH− (aq), soit comme réactifs soit comme produits.
Dans ces cas, les équations représentant les réactions redox peuvent être très difficiles à équilibrer par simple inspection, et l’utilisation d’une approche systématique connue sous le nom de la méthode des demi-équations est utile. Cette approche implique les étapes suivantes :
- Divisez l’équation en demi-réactions d’oxydation et de réduction composant son squelette.
- Équilibrer chaque demi-équation pour tous les éléments autres que O et H.
- Équilibrer chaque demi-équation pour les atomes O en ajoutant des molécules d’eau selon les besoins dans l’équation.
- Équilibrer chaque demi-équation pour les atomes H en ajoutant des protons comme requis pour l’équation.
- Enfin, équilibrez les charges des éléments en ajoutant des électrons selon les besoins.
- Multiplier les demi-équations par tout entier qui est nécessaire pour égaliser le nombre d’électrons perdus dans la demi-réaction d’oxydation par le nombre d’électrons acquis dans la demi-réaction de réduction.
- Ajoutez les deux demi-équations et simplifiez davantage en annulant les espèces communes des deux côtés de l’équation.
- Si la réaction se produit dans un milieu alcalin, ajouter des ions OH− à l’équation obtenue à l’étape 7 pour neutraliser les protons (ajoutés en nombres égaux des deux côtés de l’équation) et simplifiez.
- Vérifiez l’équation pour vous assurer que les charges sur les atomes sont équilibrées.
Ce texte est adapté de Openstax, Chemistry 2e, Chapter 17 : Introduction, et Openstax, Chemistry 2e, Section 17.2 : Récapitulatif sur la chimie rédox.
