6.8:
恒压量热法
6.8:
恒压量热法
通过量热仪测量的温度变化可用于得出所研究过程传递的热量。在量热仪中,系统定义为发生化学或物理变化的一种或多种物质,或者换句话说,是反应,并且周围环境都是所有其他物质,包括溶液和量热仪中提供热量的任何其他成分进入系统或从系统吸收热量。
在讨论化学反应的量热法之前,请考虑一个更简单的示例,它说明了量热法背后的核心思想。假设将高温的高温金属放在诸如冷水之类的低温物质中。热量将从铁水流到水中。金属的温度将降低,水的温度将升高,直到两种物质具有相同的温度-即达到热平衡为止。如果这在热量计中发生,则所有热量都在两种物质之间传递,而其外部环境不会吸收或损失热量。在这些理想情况下,净热变化为零:

可以重新安排这种关系,以表明金属获得的热量等于水所散失的热量:

因此,两种物质的热量(变化)大小相同。负号仅表示 q metal 和 q 水在热流方向上相反(增益或损耗),但未表示 q 值的算术符号(根据定义,该值取决于所讨论的问题是变热还是变热)。在所描述的特定情况下, q metal 是负值,而 q 水是正值,因为热量是从金属转移到水中。
使用量热法确定化学反应中涉及的热量时,适用相同的原理。量热仪吸收的热量通常足够小,以至于通常可以忽略不计,并且量热仪可以最大程度地减少与外界环境的能量交换。当热量计中的溶液发生放热反应时,反应产生的热量会被溶液吸收,从而使温度升高。当发生吸热反应时,所需的热量会从溶液的热能中吸收,从而降低溶液的温度。温度变化(Δ T )以及比热( c soln )和溶液质量( m soln ),然后可以用来计算这两种情况下的热量( q soln )。
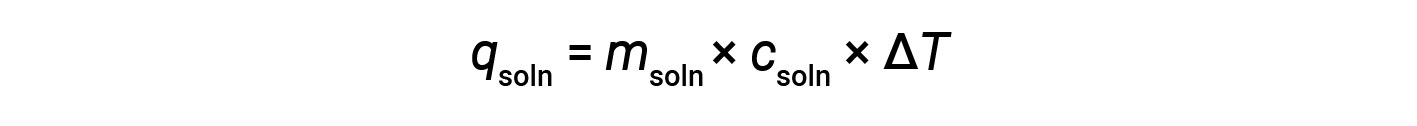
简单的量热仪—称为咖啡杯量热仪-由两个嵌套的聚苯乙烯杯构成,并用一个松散的盖子封闭。咖啡杯量热仪用于测量溶液(主要是水溶液)中发生的反应热,其体积变化不大或变化很小。由于在化学反应过程中既不会产生能量也不会破坏能量,因此在反应(“系统”)中产生或消耗的热量 q rxn ,以及吸收的热量或解决方案(“周围环境”)丢失的 q soln 必须加起来为零:
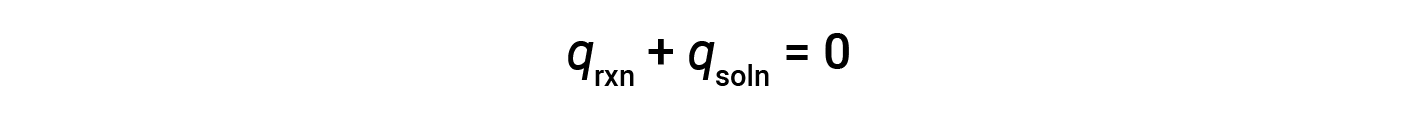
这意味着反应中产生或消耗的热量等于溶液吸收或损失的热量:
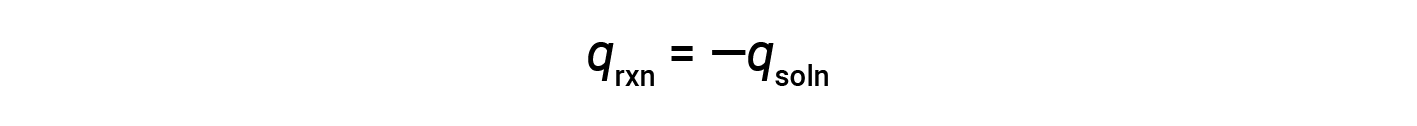
咖啡杯量热仪是恒压量热仪,测得的反应热等于焓变。
本文改编自 Openstax,化学2e,第5.2节:量热法。
おすすめの記事
- Banna, M. Salim. "A heater for constant-pressure calorimetry." Journal of Chemical Education 63, no. 11 (1986): 997.
- Ruekberg, Ben. "An economical, safe, and sturdy student calorimeter." Journal of Chemical Education 71, no. 4 (1994): 333.
- Stankus, John J., and Jennifer D. Caraway. "Replacement of coffee cup calorimeters with fabricated beaker calorimeters." Journal of Chemical Education 88, no. 12 (2011): 1730-1731.
