17.2:
Entropia
17.2:
Entropia
As partículas de sal que se tenham dissolvido em água nunca se voltam a juntar espontaneamente em solução para voltar a formar partículas sólidas. Além disso, um gás que se tenha expandido em um vácuo permanece disperso e nunca se reagrupa espontaneamente. A natureza unidirecional desses fenómenos é o resultado de uma função de estado termodinâmico chamada entropia (S). A entropia é a medida da extensão em que a energia é dispersa em todo um sistema, ou seja, é proporcional ao grau de desordem de um sistema termodinâmico. A entropia pode aumentar (ΔS > 0, o distúrbio aumenta) ou diminuir (ΔS <, o distúrbio diminui) como resultado de alterações físicas ou químicas no sistema. A variação da entropia é a diferença entre as entropias dos estados final e inicial: ΔS = Sf – Si.
A Teoria dos Microestados de Boltzmann
Um microestado é uma configuração específica de todas as localizações e energias dos átomos ou moléculas que formam um sistema. A relação entre a entropia de um sistema e o número de microestados possíveis (W) é S = k ln W, onde k é a constante de Boltzmann, 1,38 × 10−23 J/K.
A mudança na entropia é
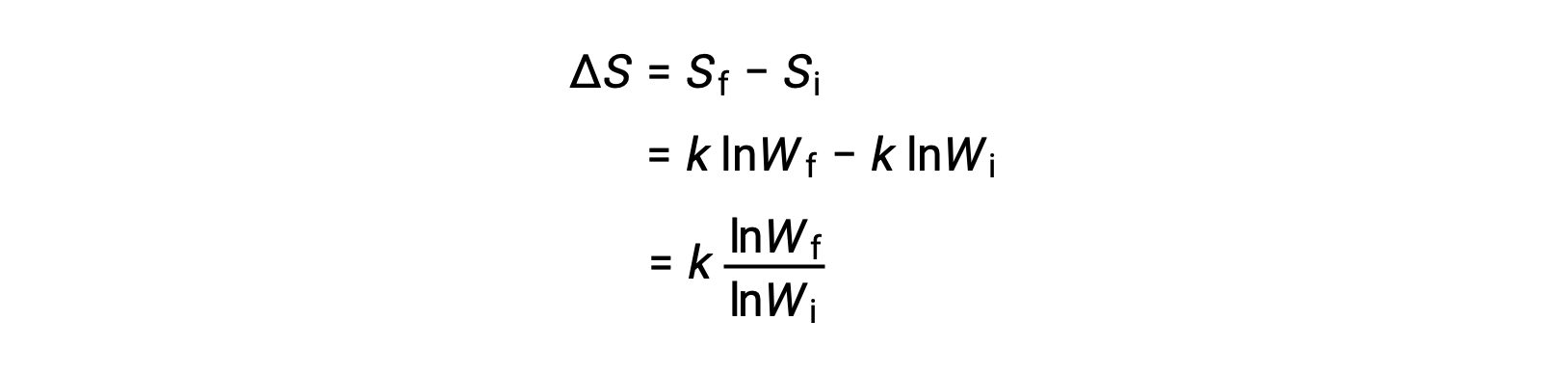
Um sistema que tem um maior número de microestados possíveis é mais desordenado (entropia mais alta) do que um sistema ordenado (entropia mais baixa) com um menor número de microestados. Para processos que envolvam um aumento no número de microestados, Wf > Wi, a entropia do sistema aumenta e ΔS > 0. Por outro lado, os processos que reduzem o número de microestados, Wf < Wi, produzem uma diminuição na entropia do sistema, ΔS < 0.
Considere a distribuição de um gás ideal entre dois frascos ligados. Inicialmente, as moléculas de gás estão confinadas a apenas um dos dois frascos. A abertura da válvula entre os frascos aumenta o volume disponível para as moléculas de gás (a energia é mais dispersa através de um domínio maior) e, correspondentemente, o número de microestados possíveis para o sistema. Uma vez que Wf > Wi, o processo de expansão envolve um aumento da entropia (ΔS > 0) e é espontâneo.
Uma abordagem semelhante pode ser usada para descrever o fluxo espontâneo de calor. Um copo de chá quente dispersa uniformemente a sua energia sobre um maior número de partículas de ar na sala mais fria, resultando em um maior número de microestados.
Generalizações Relativas à Entropia
As relações entre entropia, microestados, e dispersão matéria/energia permitem generalizações quanto à entropia relativa das substâncias e a previsão do sinal de alterações da entropia para processos químicos e físicos.
Na fase sólida, os átomos ou moléculas estão restritos a posições quase fixas em relação uns aos outros e são apenas capazes de modestas oscilações sobre essas posições. Assim, o número de microestados é relativamente pequeno. Na fase líquida, os átomos ou moléculas são livres de se moverem sobre e ao redor uns dos outros, embora permaneçam relativamente próximos uns dos outros. Assim, o número de microestados é correspondentemente maior do que para o sólido. Como resultado, Slíquido > Ssólido e o processo de conversão de uma substância de sólido para líquido (fusão) caracteriza-se por um aumento da entropia, ΔS > 0. Pela mesma lógica, o processo recíproco (solidificação) exibe uma diminuição da entropia, ΔS < 0.
Na fase gasosa , um determinado número de átomos ou moléculas ocupa um volume muito maior do que na fase líquida, correspondendo a um número muito maior de microestados. Consequentemente, para qualquer substância, Sgás > Slíquido > Ssólido e os processos de vaporização e sublimação envolvem igualmente aumentos na entropia, ΔS > 0. Da mesma forma, as transições de fase recíprocas—condensação e deposição—envolvem diminuições na entropia, ΔS < 0.
De acordo com a teoria cinética molecular, a temperatura de uma substância é proporcional à energia cinética média das suas partículas. Aumentar a temperatura de uma substância resultará em vibrações mais extensas das partículas em sólidos e em traduções mais rápidas das partículas em líquidos e gases. A temperaturas mais elevadas, a distribuição de energias cinéticas entre os átomos ou moléculas da substância é também mais dispersa do que a temperaturas mais baixas. Assim, a entropia para qualquer substância aumenta com a temperatura.
A entropia de uma substância é influenciada pela estrutura das partículas (átomos ou moléculas) que compõem a substância. No que diz respeito às substâncias atómicas, átomos mais pesados possuem uma entropia superior a uma determinada temperatura do que átomos mais leves, o que é consequência da relação entre a massa de uma partícula e o espaçamento dos níveis de energia translacional quantizados. Para as moléculas, um maior número de átomos aumenta o número de formas através das quais as moléculas podem vibrar e, assim, o número de microestados possíveis e a entropia do sistema.
Por fim, variações nos tipos de partículas afetam a entropia de um sistema. Em comparação com uma substância pura, na qual todas as partículas são idênticas, a entropia de uma mistura de dois ou mais tipos de partículas diferentes é maior. Isto deve-se às orientações e interações adicionais que são possíveis em um sistema composto por componentes não idênticos. Por exemplo, quando um sólido se dissolve em um líquido, as partículas do sólido experienciam maior liberdade de movimento e interações adicionais com as partículas de solvente. Isto corresponde a uma dispersão mais uniforme da matéria e da energia e a um maior número de microestados. O processo de dissolução envolve, portanto, um aumento da entropia, ΔS > 0.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.2: Entropy.
