16.12:
Formazione di ioni complessi
20,092 Views
•
•
Un tipo di chimica acido-base di Lewis comporta la formazione di uno ione complesso (o un complesso di coordinazione) che comprende un atomo centrale, tipicamente un catione metallico di transizione, circondato da ioni o molecole chiamate ligandi. Questi ligandi possono essere molecole neutre come H2O o NH3, o ioni come CN− o OH−. Spesso, i ligandi agiscono come basi di Lewis, donando una coppia di elettroni all’atomo centrale. Questi tipi di reazioni acido-base di Lewis sono esempi di un’ampia sottodisciplina chiamata chimica di coordinazione – l’argomento di un altro capitolo di questo testo.
La costante di equilibrio per la reazione di uno ione metallico con uno o più ligandi per formare un complesso di coordinazione è chiamata costante di formazione (Kf) (a volte chiamata costante di stabilità). Per esempio, lo ione complesso [Cu(CN)2] − è prodotto dalla reazione
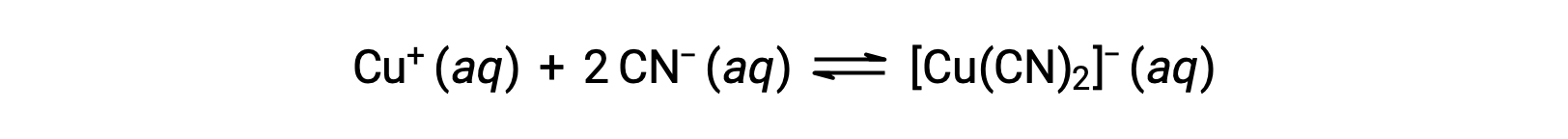
La costante di formazione per questa reazione è
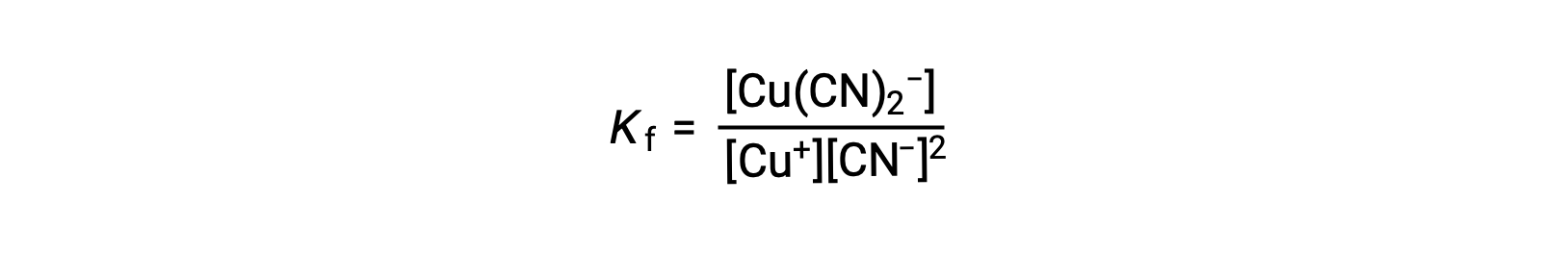
In alternativa, può essere considerata la reazione inversa (decomposizione dello ione complesso), nel qual caso la costante di equilibrio è una costante di dissociazione (Kd). Secondo la relazione tra costanti di equilibrio per le reazioni reciproche descritte, la costante di dissociazione è l’inverso matematico della costante di formazione, Kd = Kf−1.
Come esempio di dissoluzione per formazione di ioni complessi, considera cosa succede quando l’ammoniaca acquosa viene aggiunta a una miscela di cloruro d’argento e acqua. Il cloruro d’argento si dissolve leggermente in acqua, dando una piccola concentrazione di Ag+ ([Ag+] = 1,3 × 10−5 M):
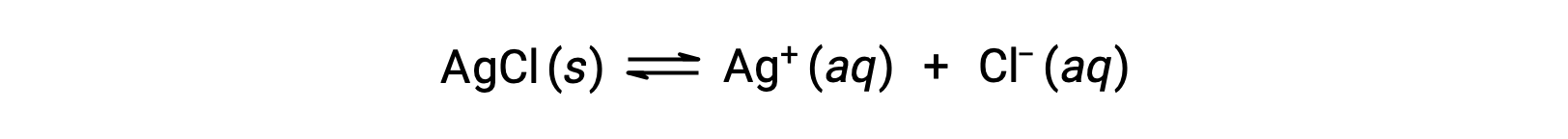
Tuttavia, se NH3 è presente nell’acqua, lo ione complesso, [Ag(NH3)2]+, può formarsi secondo l’equazione:
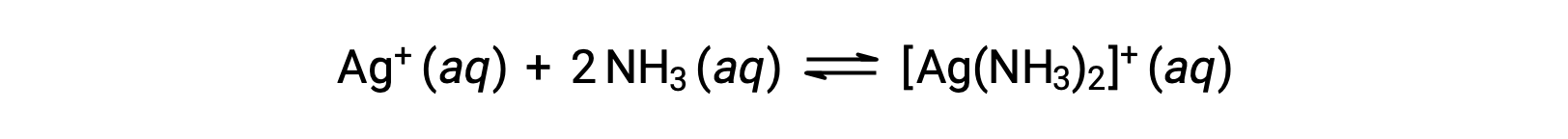
Questo testo è adattato da Openstax, Chemistry 2e, Section 15.2: Lewis Acids and Bases.
