16.12:
تكوين الأيونات المعقّدة
20,092 Views
•
•
يتضمن نوع من كيمياء حمض-قاعدة لويس تكوين أيون معقد (أو مركب تنسيق) يشتمل على ذرة مركزية، عادةً كاتيون معدني انتقالي، تحيط به أيونات أو جزيئات تسمى الروابط. يمكن أن تكون هذه الروابط جزيئات محايدة مثل H2O or NH3 أو أيونات مثل CN− or OH− في كثير من الأحيان، تعمل الروابط كقواعد لويس، حيث تتبرع بزوج من الإلكترونات للذرة المركزية. هذه الأنواع من تفاعلات حمض-قاعدة لويس هي أمثلة على مجال فرعي واسع يسمى كيمياء— التنسيق وهو موضوع لفصل آخر في هذا النص.
يسمى ثابت التوازن لتفاعل أيون فلز مع واحد أو أكثر من الروابط لتشكيل معقد تنسيق بثابت التكوين (Kf) (يُسمى أحيانًا a ثابت الاستقرار). على سبيل المثال، يتم إنتاج الأيون المركب [Cu(CN)2]− بواسطة التفاعل
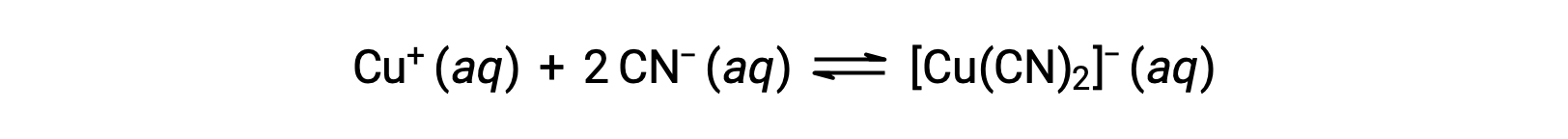
ثابت التكوين للتفاعل هذا هو
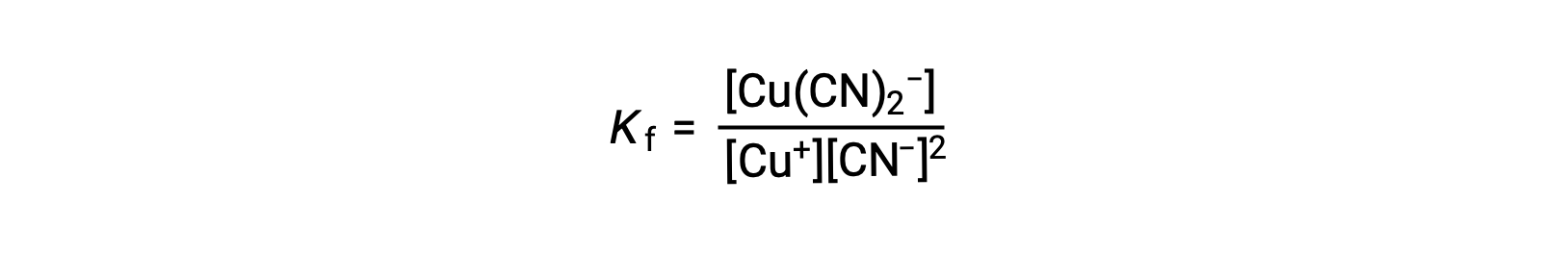
بدلاً من ذلك، يمكن اعتبار التفاعل العكسي (تحلل الأيون المركب)، وفي هذه الحالة يكون ثابت التوازن هو ثابت التفكك (Kd). وفقًا للعلاقة بين ثوابت التوازن للتفاعلات المتبادلة الموصوفة، فإن ثابت التفكك هو المعكوس الرياضي لثابت التكوين، Kd = Kf−1.
كمثال على الانحلال عن طريق تكوين أيون معقد، ضع في اعتبارك ما يحدث عند إضافة الأمونيا المائية إلى خليط من كلوريد الفضة والماء. يذوب كلوريد الفضة قليلاً في الماء، مما يعطي تركيزًا صغيرًا من Ag+ ([Ag+] = 1.3 × 10−5 M):
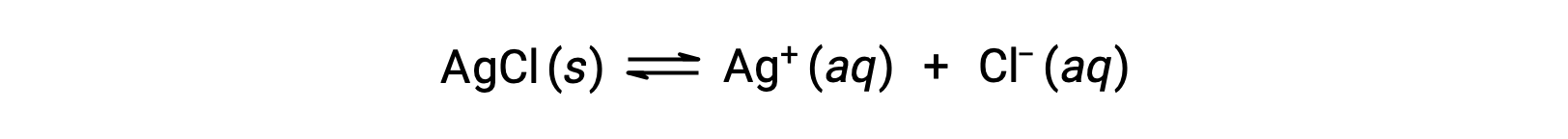
ومع ذلك، إذا كان NH3 موجودًا في الماء، فإن الأيون المركب، [Ag(NH3)2]+، يمكن أن يتشكل وفقًا للمعادلة:
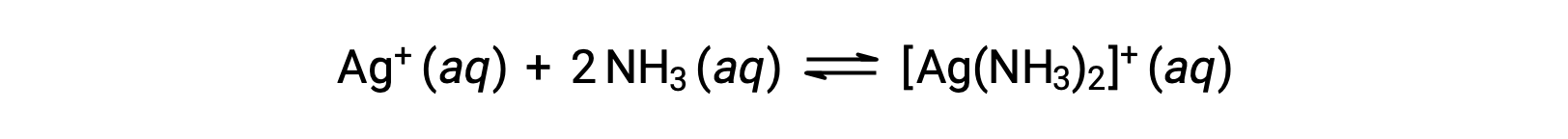
هذا النص مقتبس من Openstax, Chemistry 2e, Section 15.2: Lewis Acids and Bases.
