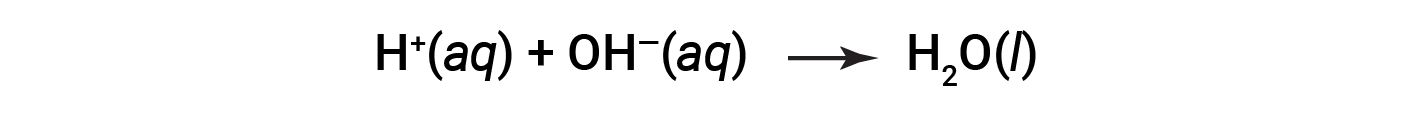4.12:
산, 염기, 중화반응
4.12:
산, 염기, 중화반응
산염 염기 반응은 수소 이온, H+,다른 하나의 화학 종에서 전송되는 하나입니다. 이러한 반응은 세포 나 호수와 바다 내의 화학 적 변화에서 부터 비료, 제약 및 사회에 필수적인 기타 물질의 산업 규모의 생산에 이르기까지 수많은 자연 및 기술 공정에 중점을 두습니다.
산을 정의하는 방법에는 여러 가지가 있습니다. 수성 용액의 맥락에서 산은 수소 이온을 생산하기 위해 용해되는 물질입니다.

이것은 스웨덴 화학자 스반테 아레니우스 (1859-1927)의 이름을 따서 명명 된 산의 아레나이트누스 정의입니다. 기호 H+로표현되는 수소 이온을 양성자라고 합니다. 용액에서 양성자는 화학적으로 산소에 고독한 쌍을 통해 물 분자와 결합하여 하이드로늄 이온, H3O+를형성합니다.
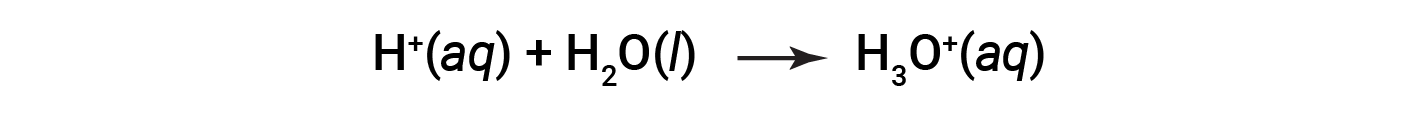
산의 이온화를 위한 화학 방정식은

이런 식으로 물과 완전히 반응하는 산은 강한 산이라고 합니다. HCl, HNO3및 HBr은 몇 가지 예입니다.
일상 생활에서 발생하는 대부분의 산은 약한 산입니다. 과일의 구연산, 식초의 아세트산, 우유의 젖산은 몇 가지 예입니다. 약한 산의 친숙한 예는 아세트산, 식품 식초의 주요 성분입니다. 일반적인 조건하에서 물에 용해될 때, 아세트산 분자의 약 1%만이 이온화된 형태로 존재하며, CH3CO2–.

위의 방정식에서 이중 화살표를 사용하면 이 프로세스의 부분 반응 측면을 나타냅니다.
베이스는 수산화 이온을 산출하기 위해 물에 용해 되는 물질입니다, OH–. 가장 일반적인 기지는 알칼리 또는 알칼리 대지 금속 양이온(그룹 1 및 2)과 수산화이온(예를 들어, NaOH 및 Ca(OH)2와결합된 이온 화합물이다. 이전에 논의된 산 화합물과달리, 이러한 화합물은 물과 화학적으로 반응하지 않습니다. 대신, 그들은 용해 및 해리, 용액에 직접 수산화 이온을 방출. 예를 들어, KOH와 Ba (OH)2는 물에 용해되고 양이온 (K+ 및 Ba2 +각각) 및 수산화 이온, OH−를 생성하기 위해 완전히 해리합니다. 이 기지는 물 에서 완전히 해리되는 다른 수산화물과 함께 강력한 기지로 간주됩니다.
수산화 나트륨이 물에 용해되는 것을 예로 들어 보십시오.

이 방정식은 수산화 나트륨이 기지임을 확인합니다. 물에 용해 될 때, NaOH는 Na+ 및 OH– 이온을 산출하기 위해 해리합니다. 이것은 또한 수산화 이온을 포함하는 그밖 이온 화합물에 대해 사실입니다. 해리 공정은 이온 화합물이 일반적인 조건하에서 물에 용해될 때 본질적으로 완료되기 때문에 NaOH 및 기타 이온 수산화물은 모두 강한 기지로 분류됩니다.
이온 수산화물과 는 달리, 일부 화합물은 물 분자와 화학적으로 반응하여 용해 될 때 수산화 이온을 생성합니다. 모든 경우에, 이러한 화합물은 부분적으로만 반응하므로 약한 기지로 분류됩니다. 이러한 유형의 화합물은 자연이 풍부하며 다양한 기술에서 중요한 상품입니다. 예를 들어, 약한 염기 암모니아의 글로벌 생산은 일반적으로 농업 비료, 다른 화합물의 화학 합성을 위한 원료 및 가정용 세제의 활성 성분으로 널리 사용되기 때문에 매년 100미터톤 이상입니다. 물에 용해될 때 암모니아는 여기에 표시된 것처럼 수산화 이온을 산출하기 위해 부분적으로 반응합니다.

이것은, 정의에 의하면, 암모니아 분자에 물 분자에서 H+ 이온의 전송을 포함하는 산 염기 반응이다. 일반적인 조건하에서, 용존암의 약 1%만이 NH4+ 이온으로 존재한다.
중화 반응은 반응제가 산과 염기(물는 아님)이고, 제품이 종종 소금과 물인 산염-염기 반응의 특정 유형입니다.

중화 반응을 설명하기 위해, 마그네슘 우유와 같은 전형적인 제산제 (고체 Mg (OH)의수성 현탁액이 과잉 위산 (HCl)과 관련된 증상을 완화하기 위해 섭취 될 때 어떤 일이 일어나는지 고려하십시오.

물 외에도 이 반응은 염염마그네슘을 생성합니다. H +(aq)는산으로부터(강하거나 약한)으로부터OH-(aq)와 결합하여 염기로부터(또는 약한 기저의 반응에 의해 물과 함께 생산)하여H2O(l)를형성한다. 예를 들어, HCl(강한 산)과 NaOH(강한 염기)의 수성 용액 간의 반응은 다음과 같이 기록됩니다.

HCl과 NaOH 모두 100% 이온화를 받습니다. 따라서 완전한 이온 방정식은 다음과 같이 작성될 수 있습니다.
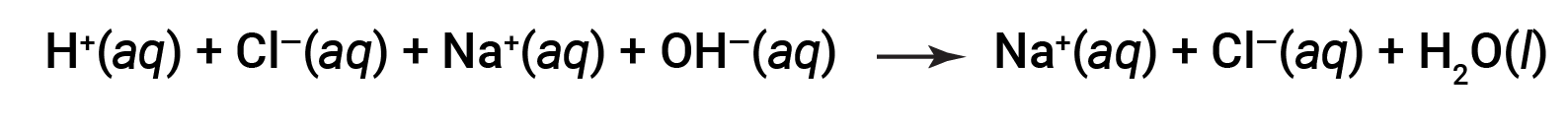
Cl– 및 Na+ 는 다음과 같은 그물 이온 방정식을 주는 취소 관중 이온이라고합니다.