12.11:
浸透圧及び溶液の浸透圧
12.11:
浸透圧及び溶液の浸透圧
天然素材や合成素材の中には、特定の大きさ、形状、極性、電荷などを持つ分子やイオンだけが透過できる選択的透過性を示すものが数多くあります。生物の細胞膜は自然界における選択的透過の優れた例であり、血液中の代謝老廃物を除去するための透析チューブは、より単純化した技術例です。それらがどのように製造されるかに関係なく、これらの材料は一般に半透膜と呼ばれます。
U字型の装置を考えてみましょう。純粋な溶媒と溶液のサンプルは、溶媒分子だけが透過できる膜で隔てられています。溶媒分子は膜を越えて両方向に拡散します。純粋な溶媒の方が溶液よりも溶媒の濃度が高いので、これらの分子は、膜の溶媒側から溶液側へ、逆方向よりも速い速度で拡散します。その結果、純溶媒から溶液への溶媒分子の正味の移動が生じます。半透膜を介した拡散による溶媒分子の移動は、「浸透」と呼ばれるプロセスです。
上述の装置で浸透を行うと、溶媒の蓄積によって希釈された溶液の体積が増加します。それに伴い溶液の液面が上昇することで静水圧(チューブ内の溶液の柱の重さ)が高まり、溶媒分子が純粋な溶媒側に戻る速度が速くなります。この静水圧が逆方向の溶媒移動速度による浸透率と等しくなる値に達すると、溶媒分子の移動が停止します。この圧力を溶液の浸透圧(Π)といいます。希薄な溶液の浸透圧は、溶質のモル度Mと絶対温度Tとの間に次の式の関係があります。
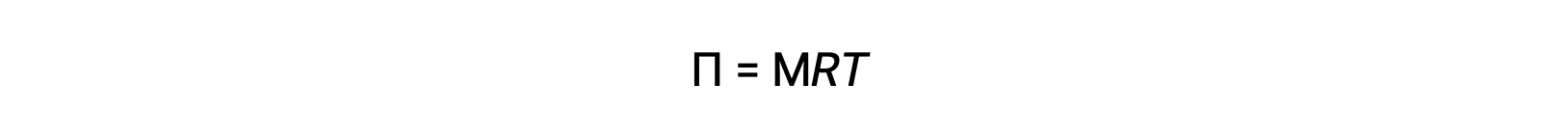
ここでRは気体定数です。
このような装置に溶液を入れ、溶液の浸透圧以上の圧力をかけると、浸透方向が反転し、溶液中の溶媒分子が純粋な溶媒中に押し出されます。この逆浸透の技術は、大規模な海水の淡水化や、小規模では純度の高い水道水の製造に利用されています。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Goodhead, Lauren K., and Frances M. MacMillan. "Measuring osmosis and hemolysis of red blood cells." Advances in physiology education 41, no. 2 (2017): 298-305.
- Garbarini, G. R., R. F. Eaton, T. K. Kwei, and A. V. Tobolsb. "Diffusion and reverse osmosis through polymer membranes." Journal of Chemical Education 48, no. 4 (1971): 226.
- Hitchcock, David I. "Osmotic pressure and molecular weight." Journal of Chemical Education 28, no. 9 (1951): 478.
