Overview
博士忠祺彼 - アメリカ合衆国農務省のソース: 研究室
酸と塩基は、プロトン (H+) と水酸化物イオン (オハイオ州-) をそれぞれ寄付することができる物質です。彼らは化学物質を記述する 2 つの極端が。酸と塩基を混合することができますアウトをキャンセルしたり、極端な効果を中和します。酸性でも基本的な物質は、中立です。ほとんどのソリューションのためのプロトンの濃度 ([H+]) の値が不便な小さなと比較することは困難より実用的な量、pH、導入されています。pH はもともと陽子のモル濃度の逆数の常用対数として定義された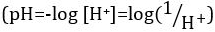 、水素イオン活量の逆数の常用対数に更新されましたが、
、水素イオン活量の逆数の常用対数に更新されましたが、 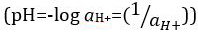 。前の定義は、今、時折 p [H] として表されます。P [H] と pH の違いは非常に小さいです。それはずっとその pH を記載 = p [H] + 0.04。それは測定の両方のタイプの 'pH' という用語を使用するの一般的です。
。前の定義は、今、時折 p [H] として表されます。P [H] と pH の違いは非常に小さいです。それはずっとその pH を記載 = p [H] + 0.04。それは測定の両方のタイプの 'pH' という用語を使用するの一般的です。
PH は 0 から 14 の範囲でスケール通常。強い酸の 1 M 溶液の pH = 0 と強力なベース、pH の 1 M 溶液 = 14。したがって、その範囲外の値が完全に可能、測定された pH 値は範囲 0 に 14 に大抵あるでしょう。純粋な水は pH が中性 = 7。PH は 7 未満は酸性と pH が 7 以上が基本。PH のスケールは対数、pH は無次元量であります。7 以下各全体の pH 値は、10 x より次の整数よりも酸性です。たとえば、4 の pH は 10 x より 5 から 6 の pH よりもより酸性 (10 x 10) x 100 の pH よりも酸性です。7 より基本的な x 10 は、それぞれの上記の pH 値の true (またはアルカリ) を保持する同じ次の下限の全体値より。たとえば、10 の pH は 9 の pH よりもより基本的な x 10 です。
Principles
溶液の pH 正確かつ容易に決定される電気化学的測定 (プロトン) の pH を pH メーターと呼ばれるデバイスを-(通常ガラス) 電極と参照電極 (通常塩化銀や塩化第一水銀)。理想的には、陽子の電極電位、 Eとして書き込むことができます。

Eが測定可能性は、 E0は標準電極電位、H += 1 mol/L、 Rは気体定数、 Tはケルビンの温度、 Fはファラデー定数。
PH 電極は、電位 (E)、溶液の pH に比例した開発ソリューションと接触して特別に調合、pH に敏感なガラスを使用しています。参照電極は、いかなる温度でも一定の可能性を維持するために設計され、pH 測定ソリューション内の回路を完了する機能します。PH 電極の潜在的な既知の参照を提供します。PH および参照電極の電位の違いは、pH に比例してミリボルト (mV) 信号を提供します。実習では、複合ガラス電極は組み込みの参照電極です。知られている水素イオン活量の緩衝溶液に対してそれを校正します。ほとんどの pH センサー、(理論的に理想的な) 勾配または-59.16 の感度に 7.0 の ph 0 mV の信号を生成する設計されています mV/pH 25 ° C で2 つ以上の緩衝液は、「坂」が理想的なからわずかに異なる場合がありますという事実を収容するために使用されます。商業標準緩衝液は、通常、25 ° C および他の温度に適用される補正係数で pH 値の情報と来る。
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. pH 校正
- 「パワー」ボタンを押すとメーターの電源を入れます。
- それはおよび/または電極とではない場合は、自動温度補償 (ATC) プローブを取り付けます。
- 測定モードが pH であることを確認します。ない場合は、「モード」ボタンを押して"pH"モードは、液晶ディスプレイに表示されます。
- 必要な場合はヘルプのメーターの近くに下部のクイック リファレンス ガイドを参照してください。
- 常に校正用新鮮、未使用で有効期限内の pH のバッファーを使用します。バッファーは、テスト ソリューションとして同じ温度にする必要があります。
- 蒸留水とし、校正 (すなわち、pH 7.00) に使用されているバッファーの pH 電極をすすいでください。
- PH 電極を中性 pH のバッファー (すなわち、pH 7.00) に浸し。磁気バーを使用してバッファーをかき混ぜる (~ 30 の緩やかなペースで s) 最良の結果のため。
- 「CAL/調べた」を押します (校正 [または標準化]/測定) '校正 (標準化)' の関数を選択します。7.00 メートル表示バッファー pH 値を設定します。
- 「読書」が安定しているときは、を受け入れるように"ENTER"ボタンを押します。主な読書は、セカンダリ ディスプレイは、残りの使用可能なバッファーのスクロールを開始する前に簡潔に点滅します。
- 蒸留水とし、(すなわち、pH 4.01) 次の校正に使用するバッファーの pH 電極をすすいでください。
- PH 電極を pH 4.01 の次のバッファーに浸る。メーターの表示は、バッファー値にロックする必要があります。
- 「読み」が安定しているときを受け入れるように"ENTER"を押します。主な読書が、一瞬を残りの使用可能なバッファー (斜面) のパーセントの効率をセカンダリ ディスプレイがスクロールを開始する前に表示されます。
- 2.2-2.7 pH 10.01 バッファーを調整する手順を繰り返します。
- メーターは 3 点校正修了測定モードに自動的に戻ります。
メモ: (1) 標準的なバッファー ph 4.01 および 10.01 はテスト サンプルの pH 範囲ごと他の適切なバッファーと取り替えられるかもしれない。(2) シングル (ニュートラル) のため-、または 2 点校正、校正が完了した後、測定に戻ります「CAL/測定」ボタンを押します。(3) 以上 3 点校正より正確な測定のため使用する場合があります。(毎日の初めに調整を実行する 4) をお勧めします。非常に正確な仕事の各測定前に pH メーターを校正する必要があります。(標準室温から温度とは異なり、ATC プローブが接続されていない場合 5) 手動でバッファーの pH 値を調整します。
2. pH 測定
- メーターが pH 測定モードにあることを確認します。
- テスト済みのソリューションの持ち越しの汚染を防ぐために蒸留水と測定間 pH 電極を徹底的にすすいでください。優しく余分なすすぎ水を削除する組織を洗浄室に電極をしみ。静電気の蓄積を引き起こす可能性がこれから電球をこすらないでください。また、テスト ソリューションで電極をすすいでください。
- テスト ソリューションまたは懸濁液に pH 電極を浸し。磁気棒を備えたソリューションをかき混ぜる (~ 30 s) 最良の結果のための校正用として同じ攪拌速度を持つ。
- PH は pH の安定したときに完了します。
- 必要な利用可能な場合は、測定の読書を凍結する「ホールド」ボタンを押します。ライブ読書を再開するには、もう一度を押します。
- 書き留めてまたはメモリに値を格納する (該当する場合)「メモリ」ボタンを押すことによって pH 値 (および必要な場合温度) を記録します。
- 複数の測定値について、手順 3.2 3.6。
- 徹底的に洗い、すべての測定が完了したら、記憶域ソリューションの電極を格納します。
メモ: 各バッファーの (1) の pH プローブ応答時間は 60 秒、5 月よりもはやする必要がありますいくつかのテストのソリューション/スラリーの長くなります。(月に一度、pH 電極の洗浄液を使用して 2) 電極プローブを洗浄する必要があります。 またはたびに汚れています。0.1 M 塩酸溶液は、一般的なクリーニングのために使用できます。グリースや細菌の汚染を洗浄するため希釈した液体洗剤と家庭洗濯漂白剤が使えます。ただし、予期しない問題を避けるためには、常に電極メーカーの勧告を参照するをお勧めします。(3) pH 電極の電球は、すべての回でしっとりする必要があります。電極に付属している電極のストレージ ソリューションでそれを保ちます。ストレージ ソリューションが利用できない場合は、4 の pH 緩衝液を使用します。どちらも利用可能な場合は、短時間のため 7 の pH 緩衝液を使用します。
PH メーターは、酸性または塩基性の水溶液を決定する電気装置、最も一般的パラメーターを監視します。
PH メーターを使用するには、pH 電極をまず測定対象範囲知られている pH 値の標準緩衝液で校正します。PH 測定をするためには、着実な読書に到達するまで、電極は試料溶液に浸漬します。電極は各サンプルの後洗浄し、すべての測定が完了したら、記憶域ソリューションに格納されています。
このビデオは、pH メーターのキャリブレーションし pH 測定を得ると同様、壊れやすい電極の処理に関するいくつかのヒントを提供する方法を実演します。
水に酸またはベースを配置すると、加水分解反応が起こります。ヒドロニウム イオンまたは反応で得られた水酸化物イオンの量は、酸性または塩基性のソリューションを決定します。この重要なプロパティは、一般的は水素イオン、プロトンとして頻繁に短くされるヒドロニウム イオンの濃度により評価されます。ほとんどのソリューションのモル/リットルで表される水素イオン濃度が非常に小さいのでより実用的な量、pH、導入されています。
pH は、水素イオンのモル濃度の負の対数として定義されます。14 0 から pH のスケールの範囲。純粋な水は 7; の pH は中性pH は 7 未満は酸性、pH が 7 以上の場合、基本的です。PH のスケールは対数なので pH の単位減少には酸味の十倍と等しくなります。
だから pH メーターの測定 pH はいかにか。PH 計の重要なコンポーネントは、水素イオン感応電極です。この電極の内溶液には、知られている水素イオン濃度が含まれています。電極は pH が未知の溶液に浸漬し、電気潜在性はテスト溶液中の水素イオン濃度の関数として開発しています。開発ポテンシャルを測定して pH 値に変換できるように、多くの場合 1 つのボディに結合参照電極と共にこの水素イオン感応電極は pH メーターに接続されます。
PH メーターの背後にある理論を理解すると、今、農業の設定での使用を見てみましょう。
PH 測定前に pH メーターを校正します。非常に正確なデータが必要な場合、開始時各日のまたは各測定する前に校正する必要があります。
サンプルの ph の範囲のバッファーを選択します。このデモでは、ph 値が 4、7、および 10 の 3 つのバッファーを pH メーターを校正します。バッファーは、新鮮な未使用、および期限が切れていないことを確認します。
まず、電源ボタンを押すことによって pH メーターに有効します。
次に、ユニットに pH プローブと自動温度補償または ATC プローブを接続します。液晶ディスプレイでは、測定モードは"pH"を確認します。ない場合は、「モード」ボタンを押して"pH"が表示されます。
記憶域バッファーから、pH 電極を取り外します。電極電球を実験中の任意の時点で乾燥しないように注意してください。蒸留水、pH 7 標準バッファーの順で電極をすすいでください。
次に、バッファーの pH 電極を浸します。最良の結果のための磁気バーを使用してバッファーをかき混ぜます。壊れやすい電極を破損しないよう、必ず電極と撹拌棒の間の距離を維持します。
キャリブレーション機能を選択する「CAL(ibration)/MEAS(urement)」ボタンをを押します。7.00 バッファー pH 値を設定します。読み込みが安定しているときは、"ENTER"を押します。主な読書は簡単に点滅します。セカンダリ ディスプレイの残りのバッファーが表示されます。電極は、次の標準的なバッファーを校正する準備が整いました。
前に、まず蒸留水、そして pH 4 標準的なバッファーとして pH 電極をすすいでください。次に、バッファーの電極を配置します。読み込みが安定しているときは、"ENTER"を押します。主な読書点滅簡潔に、残りのバッファーはセカンダリ ディスプレイに表示される前に % の効率、または勾配の表示が続きます。
最後に、pH 10 標準的なバッファーとリンスとキャリブレーションの手順を繰り返します。PH 10.01 べき着実な読書であります。"Enter"を押すし、3 点校正が行われ、メーターが自動的に測定モードに戻ります。
デバイスは、ジャガイモ畑から土壌サンプルをテストするために使用する準備ができました。
徹底的に蒸留水 pH 電極の洗浄によって pH 測定を開始します。優しく余分な水分を削除する組織を洗浄室に電極をしみ。それは静電気の蓄積を引き起こす可能性がある電球を摩擦しないように注意してください。汚染を防ぐために各サンプル間リンス ステップを実行必要があります。
次に、攪拌しながらサンプルに pH 電極を浸し。攪拌速度は校正時と同じをする必要があります。60 未満を取る必要がありますが、安定して読むのために待つ秒ほとんどのサンプルでは、pH 値を記録します。必要な場合は、読書表示を固定する「ホールド」ボタンを押します。ライブ読書を再開するには、もう一度を押します。PH 値は、ボタンの「ミ」(またはメモリ挿入) を押すことでメモリに格納できます。StO、またはメモリの場所値が簡単に表示されます。
残りのすべてのサンプルに対する、前述示されているリンスと測定の手順を繰り返します。すべての測定が完了すると、ストレージ ソリューションでそれを配置する前に徹底的に電極をすすいでください。
この実験では農業分野から複数の土壌サンプルの pH を測定しました。pH には、作物生育, 養分可用性、毒性、および病気の制御を含む多数の効果があります。さまざまな作物は、最適な成長の pH 範囲を持っています。PH を制御することによって収量を増加させながら病を最小限にできます。
土壌は地下水灌漑の有無別のトリミング回転慣行の下で 5 つのジャガイモ畑から採取。地下水かんがいは一貫してすべての 5 つのフィールドの土壌 pH を増加しました。これらのデータは、ジャガイモ畑に石灰の推薦を提供するために不可欠です。
科学の多くの分野では、pH 測定や研究の監視を必要とします。
たとえば、バイオマスをより効率的に使用して植物細胞壁の構造を理解するには、一連の反応を行った木の biomimics を合成する植物細胞壁の構造をよりよく理解することができますように。
最初のステップでは、クラフト パルプ繊維は nanofibrillated セルロースの生成に使用されました。セルロース上のグループを酸化した水酸基と反応混合物の pH が減少しました。
PH は継続的に監視し、水酸化ナトリウムを追加することで調整。アクセス可能なすべての水酸基が酸化すると、pH が変化しなく、反応が完了しました。
この環境研究では、水の流出は、都市景観のシミュレーション施設で解析しました。流出は、地元の川や湖沼の富栄養化に貢献することができる場所に栄養素および沈殿物を運ぶ可能性を秘めてください。
複数プロットの施設が建設されたと流出水が収集されました。その他の成分と一緒に、流出サンプルの pH の定量化を行った。
生命科学研究における pH、また大きな関心の生きている有機体で厳しく規制されています。この例では、蛍光 pH センサーが開発されました。
調整するこれらのセンサーの in vitro、pH 滴定行ったキュベット、センサー溶液の pH は、微小電極を用いて測定した、各 pH における発光スペクトルが得られました。このように、蛍光強度は、較正曲線を生成するために pH に対してプロット可能性があります。
これらのセンサーは、細胞内の pH を測定する使用してしました。
ゼウスの pH メーターを使用して入門を見てきただけ。今、何 pH は、メーターのしくみと 1 つを使用して pH を測定する方法を理解する必要があります。
見てくれてありがとう!
Subscription Required. Please recommend JoVE to your librarian.
Results
図 1は、栽培管理、地下水灌漑によって影響を受ける農業の土壌の pH を示します。これら土壌採取した地下水灌漑の有無別のトリミング回転慣行の下で 5 のジャガイモ畑から。PH が低いは、灌漑シリーズ フィールド 4 土壌天水と地下水の両方で観察されます。地下水かんがいは一貫してすべての 5 分野で土壌 pH を増加しました。PH 情報最適な成長を促進するために適切にジャガイモ畑を石灰の推薦のために不可欠です。

図 1。水中洗浄の有無別のトリミング管理慣行の下でジャガイモ畑の土壌の pH。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
pH は水溶液の最も一般的測定化学パラメーターの 1 つです。地方自治体および産業用アプリケーション、化学生産、農業研究および生産のための水・排水処理における重要なパラメーターです。また、環境モニタリング、化学と生命科学の研究、生化学・薬学の研究、エレクトロニクス生産および多くのアプリケーションで重要です。図 2には、いくつかの共通の物質の pH 値が一覧表示されます。
純粋な水は、7.00 の pH は中性です。化学物質は、水と混合されて、酸性又は塩基性混合物になります。酢、レモン ジュースは、洗濯用洗剤とアンモニア、基本的な酸性物質です。非常に基本的なまたは非常に酸性化学物質は、「守り」と見なされますこれらの化学物質は、厳しい焼跡をもたらすことができます。自動車のバッテリーの酸は反応性酸性化学物質です。自動車のバッテリーには、酸性雨の酸が発見した 1 つのより強力なフォームが含まれています。家庭用ドレイン クリーナーには、苛性アルカリ溶液、反応も非常にアルカリ性の薬品が含まれています。
生存システムの臓器、体液、異なる細胞コンパートメントの pH が酸塩基の恒常性と呼ばれるプロセスで通常堅く調整されます。血液の pH は通常少し基本的な pH 7.365 の値を持つです。この値は、生物学と医学における生理学的 pH として呼ばれます。プラークは、脱灰して虫歯につながる地域の酸性の環境を作成できます。酵素および他の蛋白質最適 pH 範囲を持っているとなる不活化したり、この範囲外変性します。

図 2。PH のスケールといくつかの共通項目の pH 値。
Subscription Required. Please recommend JoVE to your librarian.


