14.10:
未知数小x假设
Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
JoVE Core
Kimya
The Small x Assumption
43,063 Views
•
02:20 min
•
October 19, 2020
如果反应的平衡常数较小,则平衡位置有利于反应物。 在这种反应中,如果反应物的初始浓度高而 K c 值小,则浓度的变化可忽略不计。 在这种情况下,平衡浓度大约等于其初始浓度。 通过假设某些平衡浓度等于初始浓度,可以使用此估计值简化平衡计算。 但是,要做出此假设,弱酸或弱碱(即 x )的浓度变化必须小于其初始浓度的5%。 如果 x 大于5%,则需要使用二次方程式来求解平衡方程。  
使用代数简化假设计算平衡浓度
平衡中 0.15 M 溶液的 HCN 浓度是多少?
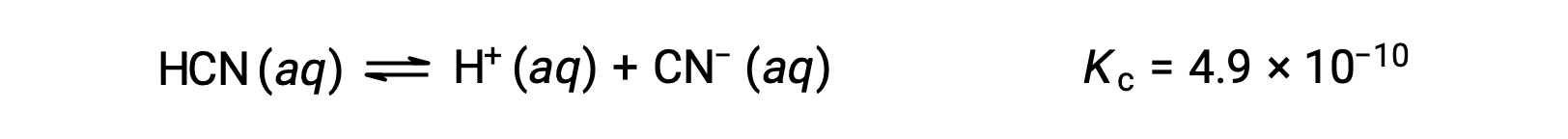
使用 x 来表示平衡上每个生成物的浓度,就可以获得此 ICE表格。
| HCN (aq) | H+ (aq) | CN− (aq) | |
| 初始浓度 (M) | 0.15 | 0 | 0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.15 − x | x | x |
将平衡浓度项代入Kc表达式
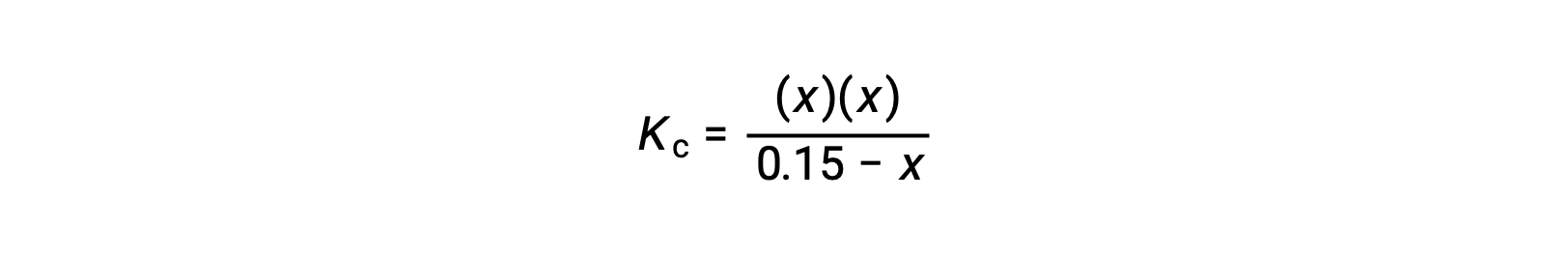
重新排列为二次式并为 x 求解
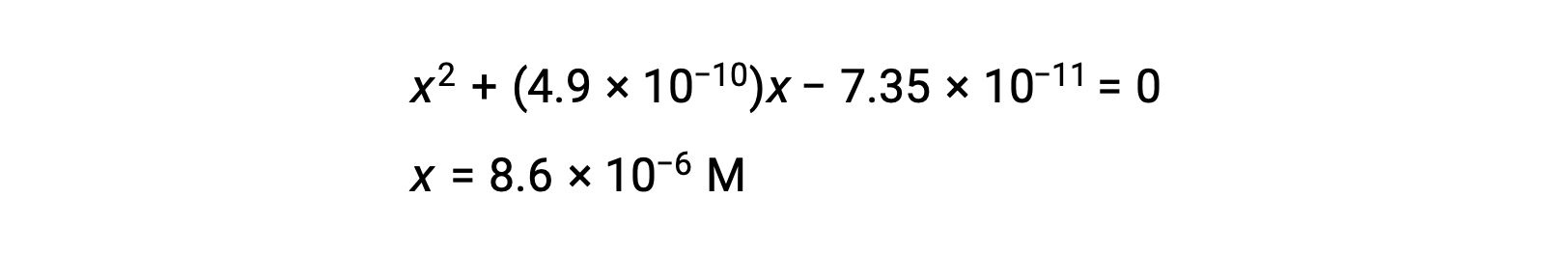
Thus, [H+] = [CN–] = x = 8.6 × 10–6 M and [HCN] = 0.15 – x = 0.15 M.
在这种情况下,浓度变化明显小于初始浓度( K 较小的结果),因此初始浓度变化可忽略不计:

此近似值允许使用更方便的数学方法进行计算,而无需求解二次方程的根:
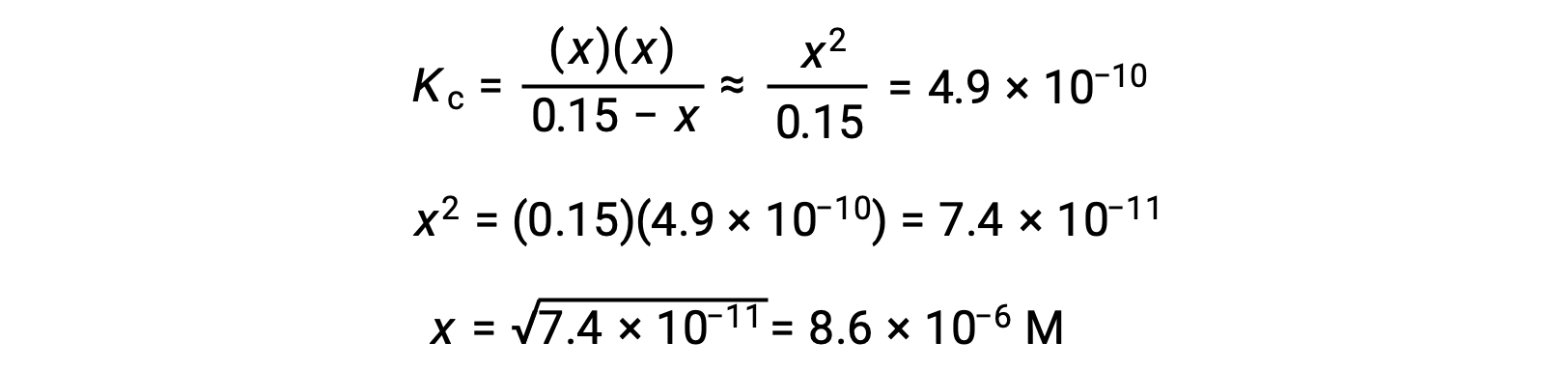
x 的计算值确实比初始浓度小
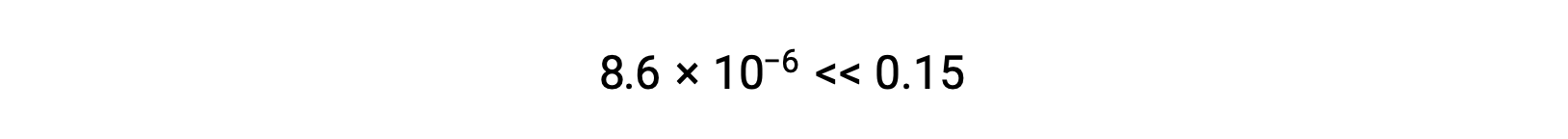
,因此近似值是合理的。 如果此简化方法要产生 x 的值而不能证明近似值合理,则需要在不进行近似值的情况下重复进行计算。
