15.11:
Détermination du pH des solutions salines
39,393 Views
•
•
Le pH d’une solution de sels est déterminé grâce à ses composants anions et cations. Les sels qui contiennent des anions de pH-neutre et des cations produisant les ions hydronium forment une solution dont le pH est inférieur à 7. Par exemple, dans une solution de nitrate d’ammonium (NH4NO3), les ions NO3− ne réagissent pas avec l’eau alors que les ions NH4+ produisent les ions hydronium qui rendent la solution acide. En revanche, les sels qui contiennent des cations de pH-neutre et des anions produisant les ions hydroxyde forment une solution dont le pH est supérieur à 7. Par exemple, dans une solution de fluorure de sodium (NaF), le Na+ est de pH neutre, mais le F– produit les ions hydroxyde et forme la solution basique. Les contre-ions d’un acide fort ou d’une base forte sont de pH-neutre et les sels formés par de tels contre-ions forment une solution neutre avec un pH égal à 7. Par exemple, dans KBr, le cation K+ est inerte et n’influence pas le pH. L’ion bromure est la base conjuguée d’un acide fort, et la force de sa base est donc négligeable (pas d’ionisation de la base notable). La solution est neutre.
Certains sels contiennent à la fois un cation acide et un anion basique. L’acidité ou la basicité globale d’une solution est déterminée par la force relative du cation et de l’anion, qui peuvent être comparées à l’aide de Ka et de Kb. Par exemple, dans NH4F, l’ion NH4+ est acide et l’ion F− est basique (base conjuguée de l’acide faible HF). En comparant les deux constantes d’ionisation : Ka de NH4+ est de 5,6 × 10−10 et le Kb de F− est de 1,6 × 10−11, de sorte que la solution est acide, puisque Ka > Kb.
Calcul du pH d’une solution de sel acide
L’aniline est une amine utilisée pour fabriquer des colorants. Elle est isolée sous forme de chlorure d’anilinium [C6H5NH3+]Cl, un sel préparé par la réaction de la base faible aniline et de l’acide chlorhydrique. Quel est le pH d’une solution 0,233 M de chlorure d’anilinium ?
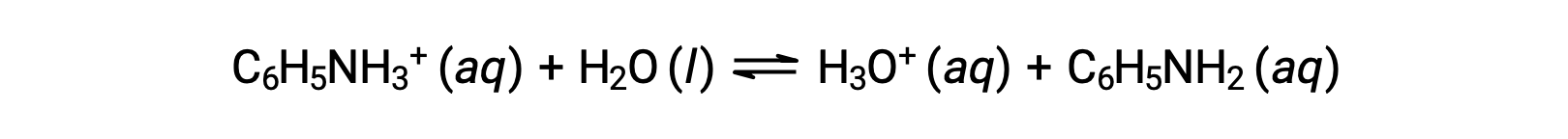
Le Ka de l’ion anilinium est déduit à partir du Kb de sa base conjuguée, l’aniline:

À l’aide des informations fournies, un tableau ICE est préparé pour ce système :
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| Concentration initiale (M) | 0,233 | ~0 | 0 |
| Changement (M) | −x | +x | +x |
| Concentration à l’équilibre (M) | 0,233 − x | x | x |
Remplacer ces termes de concentration à l’équilibre dans l’expression de Ka donne
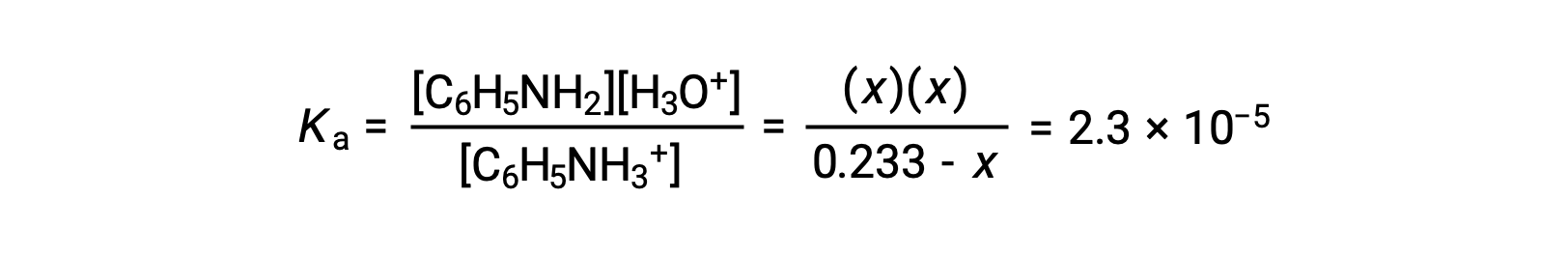
En supposant que x << 0,233, l’équation est simplifiée et résolue pour trouver x :
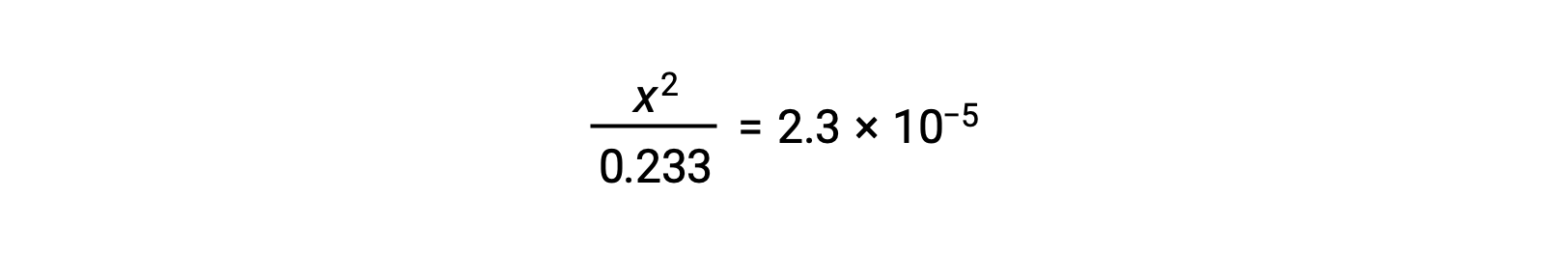

Le tableau ICE définit x comme étant la molarité en ions hydronium, et le pH est donc calculé comme
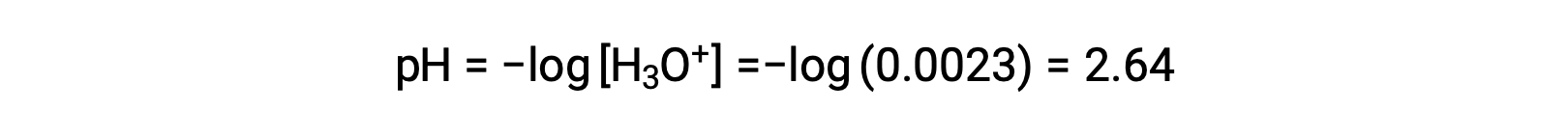
Hydrolyse de [Al(H2O)6]3+
Calculer le pH d’une solution de chlorure d’aluminium de 0,10 M qui se dissout complètement pour donner l’ion d’aluminium hydraté [Al(H2O)6]3+ en solution.
L’équation de la réaction et de Ka sont les suivantes :

Un tableau ICE avec les informations fournies est
| Al(H2O)63+ (aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (aq) | |
| Concentration initiale (M) | 0,10 | ~0 | 0 |
| Modifier (M) | −x | +x | +x |
| Concentration à l’équilibre (M) | 0,10 − x | x | x |
Remplacer les expressions des concentrations à l’équilibre dans l’équation de la constante d’ionisation donne :
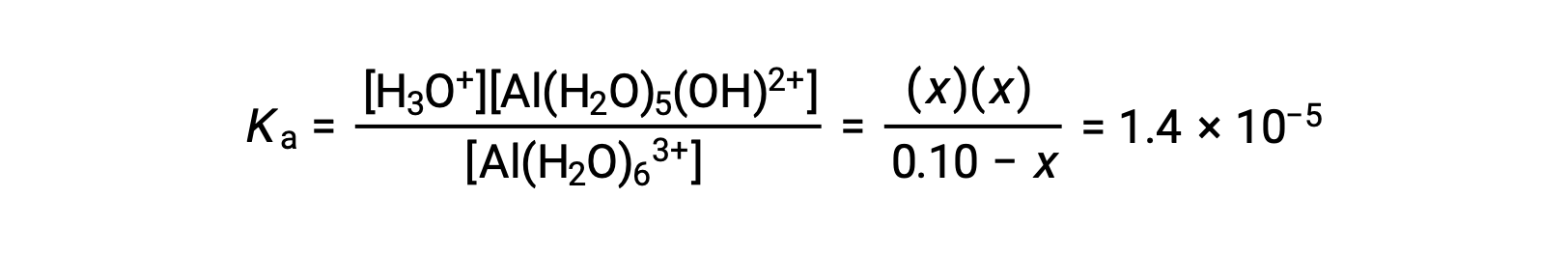
En supposant que x << 0,10 et en résolvant l’équation simplifiée, vous obtenez :
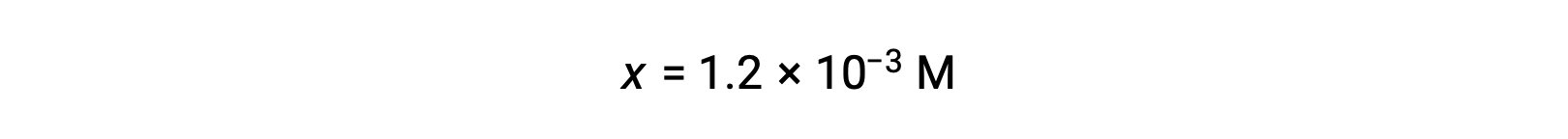
Le tableau ICE définit x comme étant égal à la concentration en ions hydronium, le pH calculé est donc à 2,92 et la solution est acide.
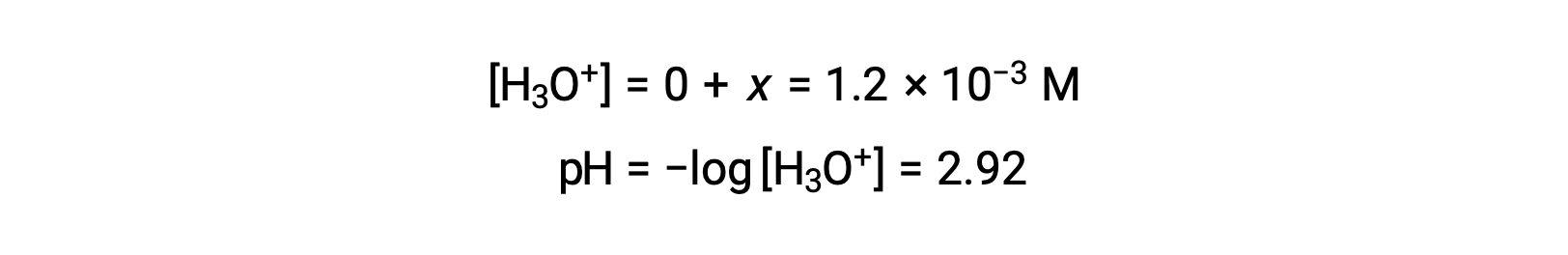
Ce texte est adapté de Openstax, Chimie 2e, Section 14.4 : Hydrolyse des sels.
