14.8:
Принцип Ле Шателье: изменение объема (давления)
29,635 Views
•
•
При равновесии газовой фазы изменения концентрации реагенты и продуктов могут происходить при изменении объема и давления. Парциальное давление, P, идеального газа пропорционально его молярной концентрации, М.
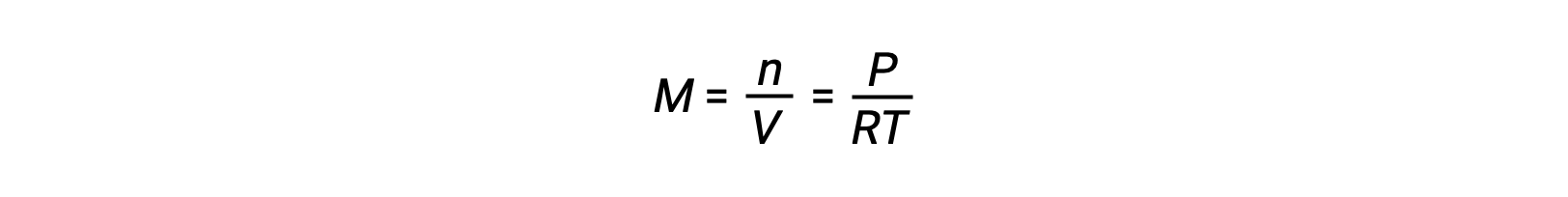
Таким образом, изменения парциального давления любого реагент или продукта по существу изменятся в концентрациях, поэтому эти изменения оказывают такое же влияние на равновесие. Помимо добавления или удаления реагенты или продуктов, давление (концентрации) видов в равновесии газовой фазы также можно изменить, изменив объем, занимаемый системой. Поскольку все виды газового равновесия занимают один и тот же объем, то изменение объема приведет к одинакового изменения концентрации как для реагенты, так и для продуктов. Для того чтобы определить, какой сдвиг, если он есть, этот тип напряжения вызовет, необходимо рассмотреть стехиометрию реакции.
При равновесии реакция N2 (g) + O2 (g) ⇌ 2 НЕТ (g) описывается реактивным соотношением
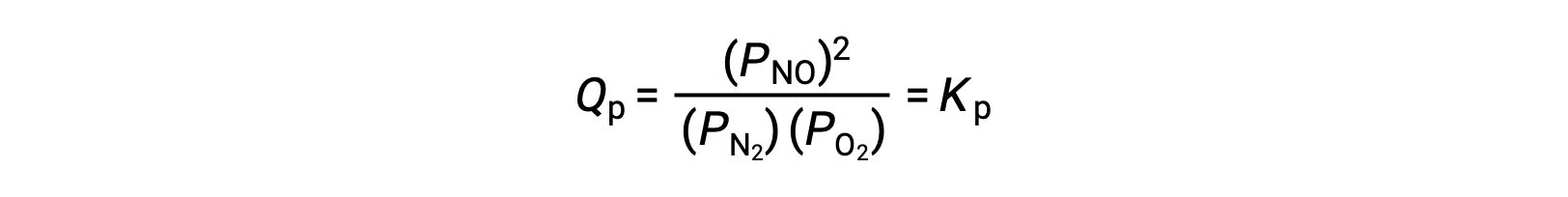
Если объем, занимаемый равновесной смесью этих видов, уменьшается в 3 раз, парциальное давление всех трех видов будет увеличено в 3 раз:
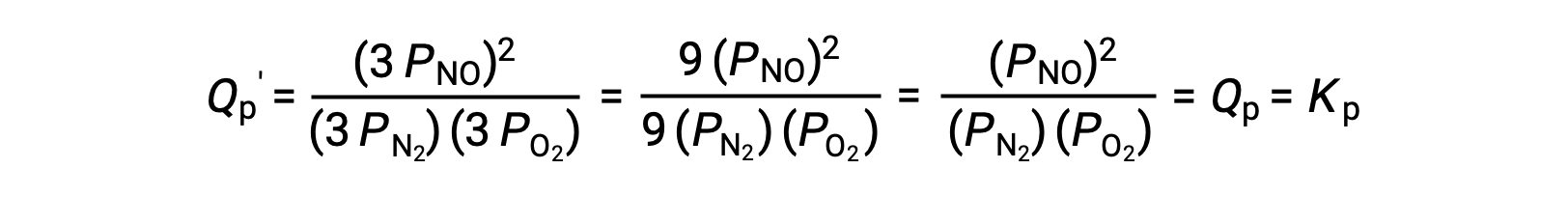
Таким образом, изменение объема этой газовой смеси не приводит к смещению равновесия.
Аналогичное лечение другой системы, 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g), однако, дает другой результат:
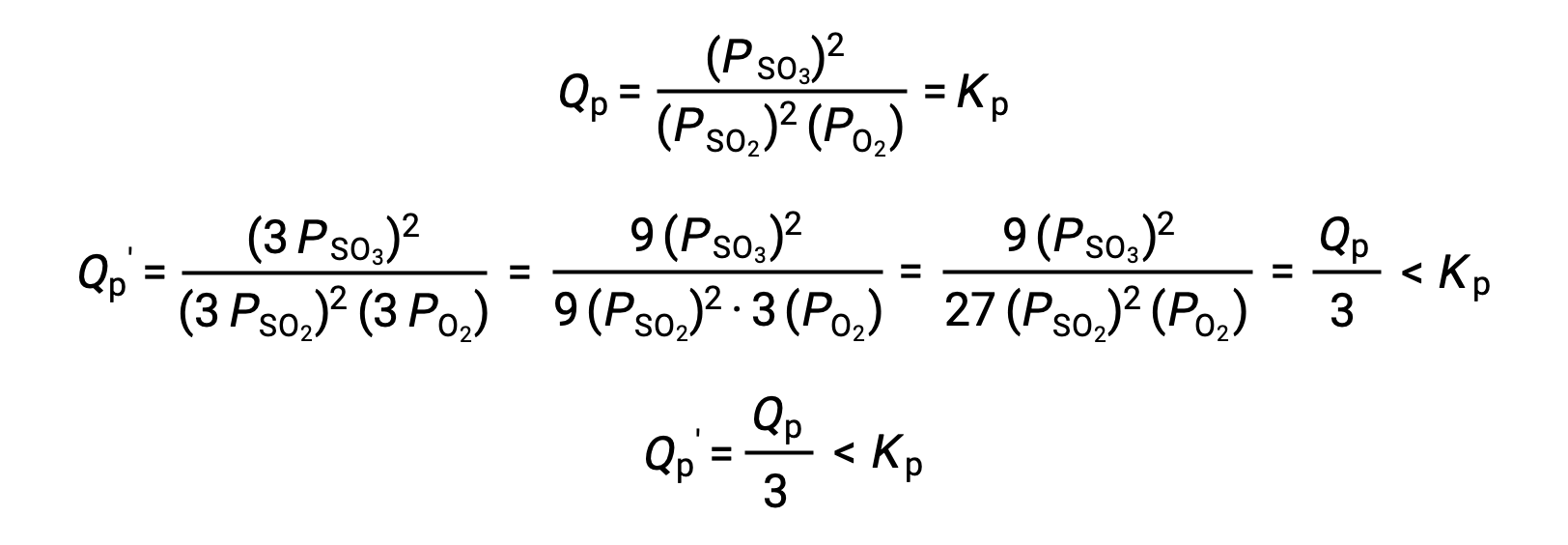
В этом случае изменение объема приводит к тому, что коэффициент реакции меньше, чем константа равновесия, и поэтому равновесие будет смещаться вправо.
Эти результаты иллюстрируют взаимосвязь между стехиометрией газового фазового равновесия и эффектом изменения давления (концентрации), вызванного объемом. Если общее молярное количество реагенты и продуктов равно, как и в первом примере, изменение объема не смеет равновесие. Если молярное количество реагенты и продуктов отличается, изменение объема смещает равновесие в направлении, которое лучше «приспосабливает» изменение объема. Во втором примере три моль реагент (SO2 и O2) дают две моль продукта (SO3), и поэтому уменьшение объема системы вызывает смещение равновесия вправо, так как при прямой реакции образуется меньше газа (2 моль), чем при обратной реакции (3 моль). И наоборот, увеличение объема этой равновесной системы приведет к смещению в сторону реагента.
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 13.3 Сдвиг равновесия: Принцип Ле-Шателье.
