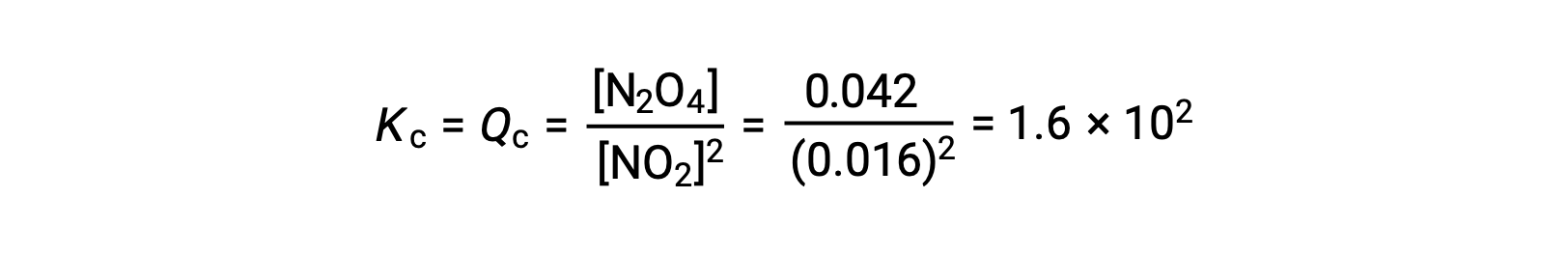14.5:
반응지수
43,856 Views
•
•
가역반응의 상태는 반응지수(Q)를평가하여 편리하게 평가된다. m A + n B ⇌ x C + y D에 의해 설명된 가역적 반응의 경우, 반응 지수는 균형 방정식의 stoichiometry에서 직접 파생됩니다.
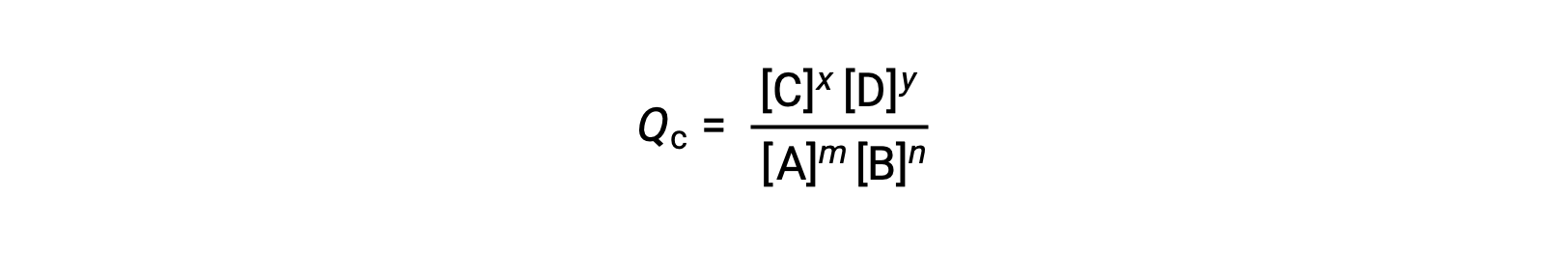
여기서 하위 스크립트 c는 표현식에서 어금니 농도의 사용을 나타낸다. 반응제와 제품이 기체인 경우, 반응 지수가 부분 압력을 사용하여 유사하게 도출될 수 있습니다.
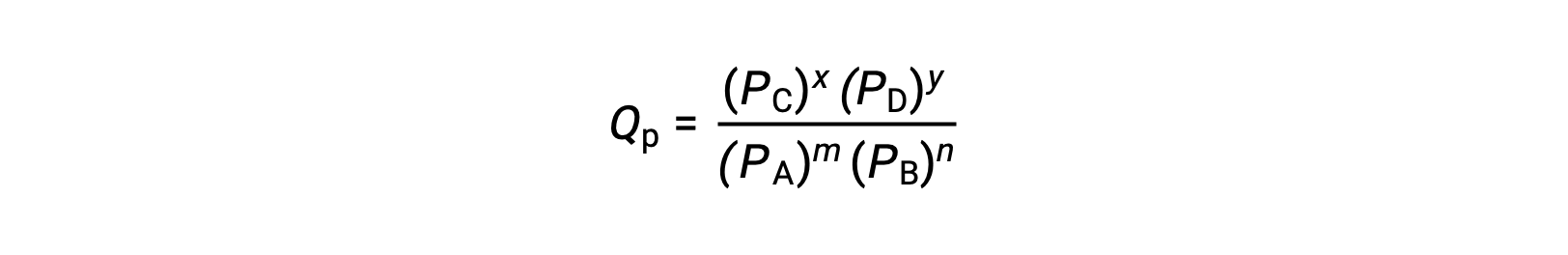
위의 반응 지수 방정식은 절대 값이 아닌 농도 및 압력에 상대값을 사용하는 보다 엄격한 식을 단순화하는 것입니다. 이러한 상대적 농도 및 압력 값은 치수가 없습니다(단위가 없습니다); 따라서 반응 지수도 마찬가지입니다.
Q의 수치 값은 반응이 평형을 향해 진행됨에 따라 다릅니다. 따라서 반응 상태를 나타내는 유용한 지표로 작용할 수 있습니다. 이 점을 설명하기 위해 이산화황의 산화를 고려하십시오.
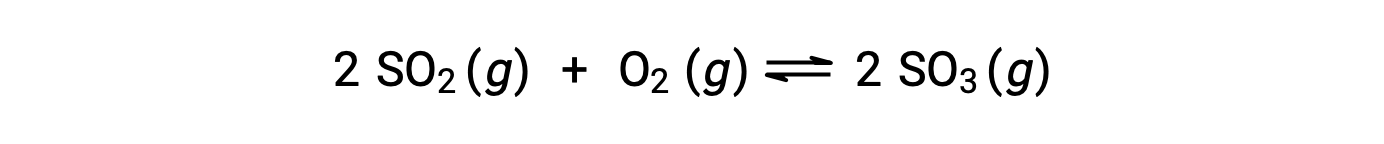
이 반응은 반응제의 혼합물로만 시작되는 두 가지 실험 시나리오, SO2 및 O2,제품만으로 시작하는 시나리오, SO3. 반응의 혼합물로만 시작되는 반응의 경우 Q는 처음에는 0과 같습니다.
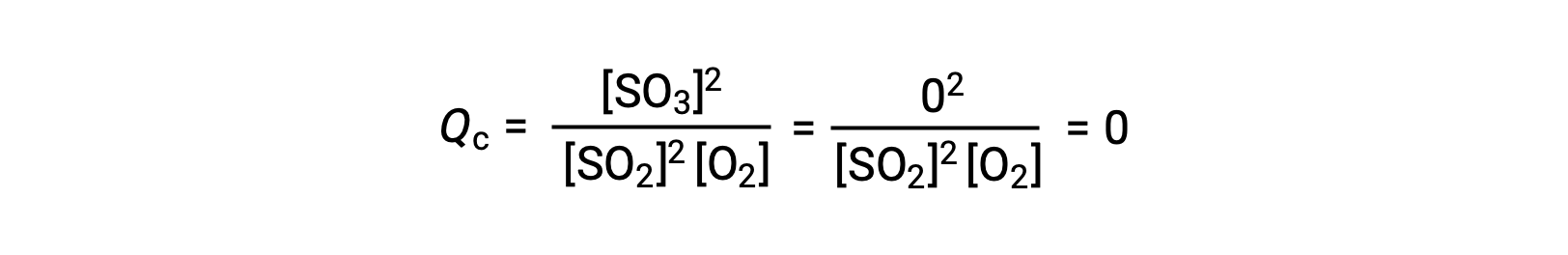
반응이 전방 방향으로 평형을 향해 진행됨에 따라, 반응 농도가 감소(Qc의분모와 마찬가지로), 제품 농도가 증가(Q c의분자와 마찬가지로), 반응 지수가 결과적으로 증가한다. 평형이 달성되면, 반응제와 제품의 농도는 Qc의값과 마찬가지로 일정하게 유지됩니다.
반응이 존재하는 제품만으로 시작하는 경우 Qc의 값은 처음에는 정의되지 않았습니다(헤아릴 수 없을 정도로 크거나 무한)입니다.
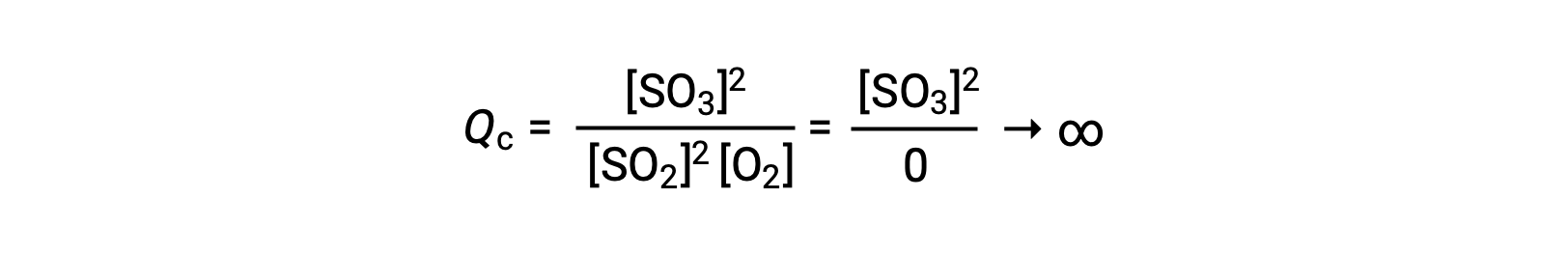
이 경우, 반응은 역방향의 평형으로 진행됩니다. Qc의 제품 농도 및 분자는 시간에 따라 감소하고, 반응 농도 및 Q c의 분모가 증가하고, 평형에서 일정해질 때까지 반응 지수가 감소합니다. 평형 시스템에서 볼 수 있는 Q의 상수값은 평형 상수, K라고합니다.
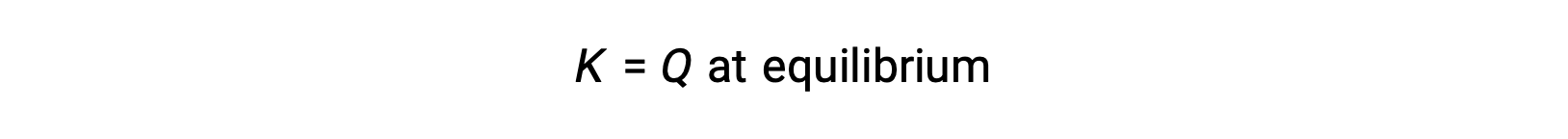
반응 지수 평가
이 방정식에 따라 기이이이산화질소 형성 이산화질소:
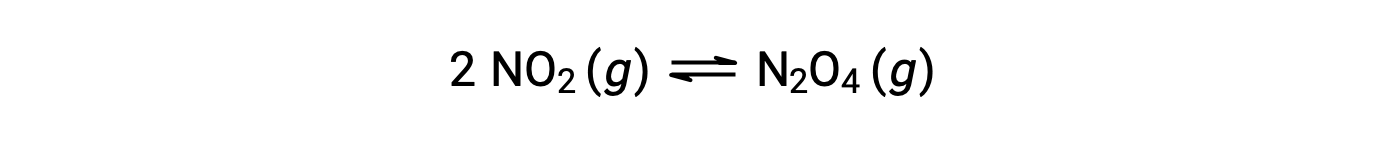
0.10 mol NO2가 25°C에서 1.0-L 플라스크에 첨가되면 평형에서 [NO2]= 0.016 M 및 [N2O4]= 0.042 M의 농도가 변화한다. 어떤 제품이 형성되기 전에 [NO2]= 0.10 M 및 [N2O4]= 0 M. 따라서
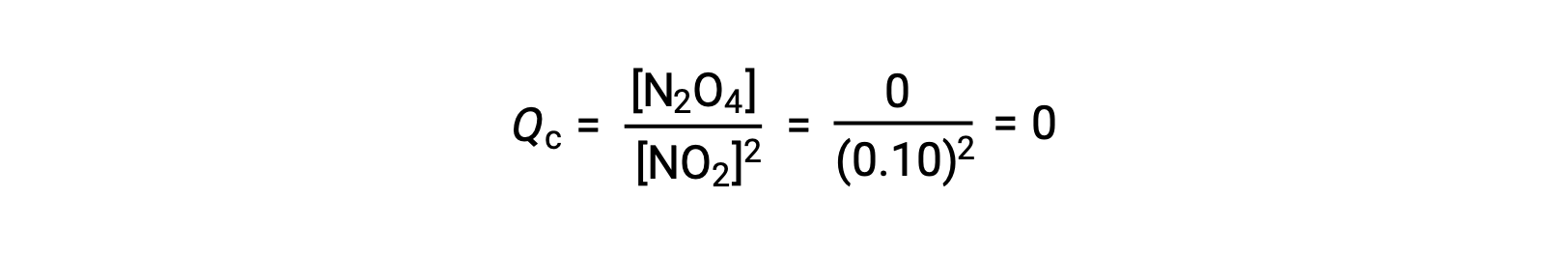
평형에서,