14.2:
La Constante de Equilibrio
39,285 Views
•
•
Considere la oxidación del dióxido de azufre:
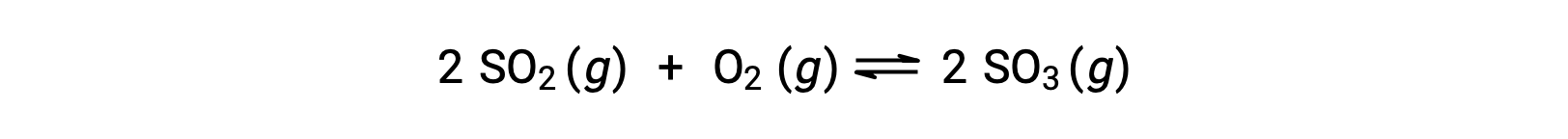
Para una reacción que comienza sólo con una mezcla de reactivos, la concentración del producto es inicialmente igual a cero. A medida que la reacción avanza hacia el equilibrio en la dirección de avance, las concentraciones de los reactivos disminuyen y la concentración del producto aumenta. Cuando se alcanza el equilibrio, las concentraciones de los reactivos y productos permanecen constantes.
Si la reacción comienza sólo con los productos presentes, la reacción avanza hacia el equilibrio en la dirección inversa. La concentración del producto disminuye con el tiempo y las concentraciones de los reactivos aumentan hasta que las concentraciones se mantienen constantes en equilibrio.
La ley de acción de masas establece que la relación entre la concentración de los productos y la concentración de los reactivos en equilibrio, elevada a sus respectivos coeficientes estequiométricos, es igual a una constante, denominada constante de equilibrio, K o Kc.
Por lo tanto, la expresión de la constante de equilibrio para la reacción anterior se escribe como:
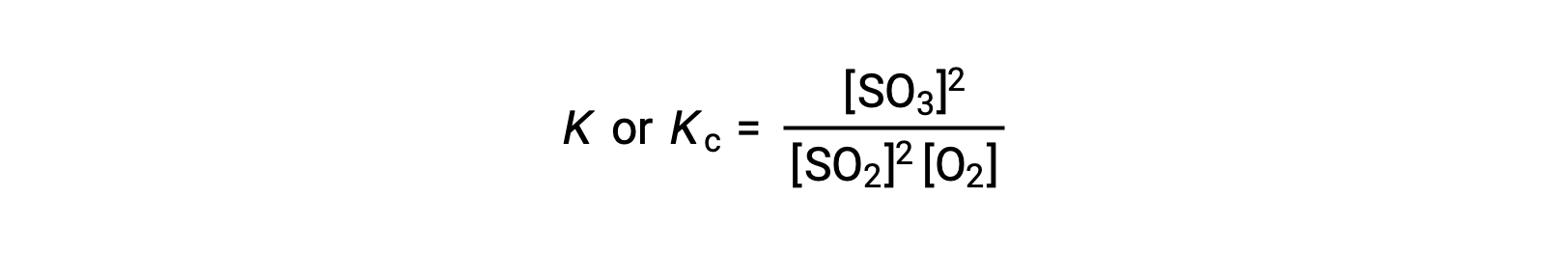
donde, el subíndice ‘c’ indica que la constante de equilibrio considera la concentración molar de reactivos y productos.
La magnitud de la constante de equilibrio refleja explícitamente la composición de una mezcla de reacción en equilibrio. Una reacción que muestre una K grande alcanzará el equilibrio cuando la mayor parte del reactivo se haya convertido en producto, mientras que una K pequeña indica que la reacción alcanza el equilibrio después de que se haya convertido muy poco reactivo. Es importante tener en cuenta que la magnitud de K no indica cuán rápida o lentamente se alcanzará el equilibrio. Algunos equilibrios se establecen tan rápidamente como para ser casi instantáneos, y otros tan lentamente que ningún cambio perceptible se observa en el curso de días, años, o más tiempo. La constante de equilibrio de una reacción puede utilizarse para predecir el comportamiento de las mezclas que contienen sus reactivos y/o productos. Como lo demuestra el proceso de oxidación del dióxido de azufre descrito anteriormente, una reacción química procederá en cualquier dirección que sea necesaria para lograr el equilibrio.
Equilibrios acoplados
Muchos sistemas en equilibrio implican dos o más reacciones de equilibrio acopladas, aquellas que tienen en común una o más especies de productos o reactantes. El valor de K de un sistema que implica equilibrios acoplados puede estar relacionado con los valores de K de las reacciones individuales. En este enfoque intervienen tres premisas básicas, como se describe a continuación:
• cambiar la dirección de una ecuación química esencialmente intercambia las identidades de los “reactantes” y “productos”, y por lo tanto la constante de equilibrio para la ecuación invertida es simplemente la recíproca de la ecuación de avance.
• El cambio de los coeficientes estequiométricos en una ecuación por algún factor x resulta en un cambio exponencial en la constante de equilibrio por ese mismo factor.
• agregar dos o más ecuaciones en equilibrio juntas produce una ecuación general cuya constante de equilibrio es el producto matemático de los valores de K de las reacciones individuales.
Expresión de la constante de equilibrio para equilibrios heterogéneos
Para equilibrios heterogéneos, que implican reactivos y productos en dos o más fases diferentes, las concentraciones de sólidos puros o líquidos puros no se incluyen en la expresión de la constante de equilibrio, como se ilustra en el siguiente ejemplo:

Esto se debe a que las concentraciones relativas de líquidos puros y sólidos puros permanecen constantes durante la reacción.</em
Este texto ha sido adaptado de las constantes de equilibrio Openstax, Química 2e, Sección 13.2.
