13.12:
酶
68,952 Views
•
•
在活生物体内,酶是细胞代谢中许多生物化学反应的催化剂。 酶的作用是通过与基质形成复合物来减少生物化学反应的活化能量。 活性能量的降低有利于生物化学反应速度的提高。
酶缺乏通常会转化为危及生命的疾病。 例如,一种遗传异常导致酶 G6PD (葡萄糖 -6 磷酸脱氢酶) 缺乏,对为细胞提供 NADPH 的代谢途径产生不利影响。
这种代谢途径的破坏可以减少红细胞中的谷硫代,从而对其他酶和血红蛋白等蛋白质造成损害。 血红蛋白的过度代谢会形成胆红素水平,从而导致黄疸,这种情况可能会变得严重。 因此,患有 G6PD 缺乏症的人必须避免某些含有化学物质的食品和药物,这些化学物质可能会对其葡萄糖苷缺乏的红细胞造成损害。
酶功能和结构
酶根据其所执行的特定功能分组为不同的类别。 例如,氧化物反应中会有氧化物喷射酶,而转移酶则会催化官能团的转移。 键形成和 ATP 水解需要配体,而水解反应和双键形成则分别由水解和 lyase 催化。 异构酶通常会催化异构化反应。
酶通常具有活性部位。 这些是分子上的特定区域,其成分形成有利于酶与特定基体 (反应物分子) 结合以形成酶基体复合体或反应中间体的形成。
两种型号—锁定型和感应型—试图解释活动站点的工作情况 (图 1)。 最简单的锁定键假说表明,活动站点和基材的分子形状是互补的—像锁中的按键一样贴合在一起 (图 1a)。 另一方面,诱导拟合假说表明酶分子是柔性的,并改变形状以适应基体中的键 (图 1b)。
然而,锁匙和锁匙模型以及诱导拟合模型都说明酶只能与特定基质结合,只能催化特定反应。
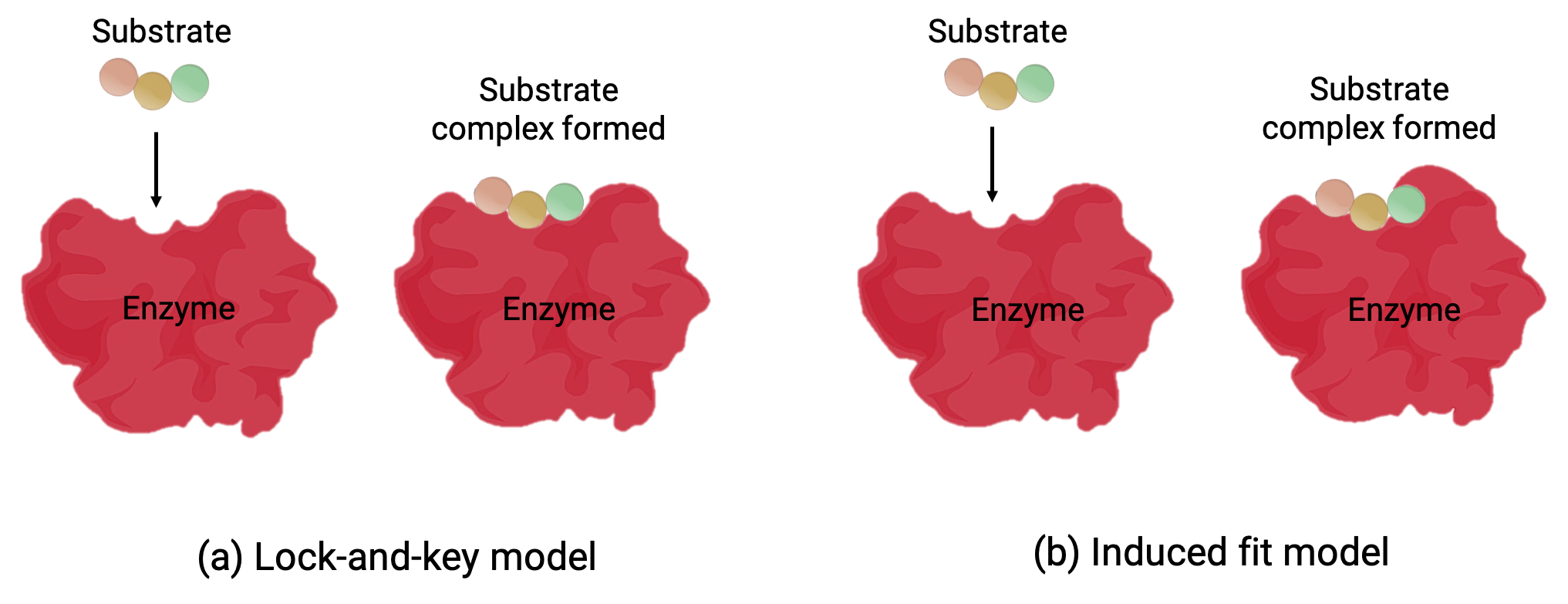
图 1 (a) 根据锁键模型,酶活性位点的形状非常适合基底。 (B) 根据感应贴合模型,活动部位具有一定的灵活性,并且可以改变形状以使用承印物进行键处理。
酶抑制剂
酶抑制过程也会中断酶的活性。 有几种常见的酶抑制类型。
在竞争性抑制期间,基质以外的分子 (天然或合成) 直接与酶的活性部位结合。 抑制剂与基质的结构和化学相似性有助于抑制剂与活性部位的结合。 因此,这种竞争性抑制剂与基质竞争,从而防止其与酶结合。 通常,增加基材浓度会抑制竞争抑制的影响。
在非竞争性抑制中,一种分子 (天然或合成) 与酶的异体 (其他) 区域 (与其活性部位不同) 结合。 抑制剂结合会导致酶活性部位发生一致性变化,从而导致酶催化反应的能力下降。 与竞争抑制不同,基质浓度的增加并不能缓解非竞争抑制的抑制效应。
