13.10:
反応速度の決定ステップ
27,198 Views
•
•
反応メカニズム同士の関係
多段階反応メカニズムでは、基本ステップの1つが他のステップよりも大幅に遅く進行することがあります。この最も遅いステップは、律速段階と呼ばれます。反応は最も遅い段階より速く進行することはできないため、律速段階は全体的な反応速度を制限します。
反応速度を決定するステップの概念は、4車線の高速道路で、車線閉鎖によりボトルネックとなっている短い区間があるという例えで理解することができます。ボトルネックが自動車の走行速度全体に影響を与えるように、最も遅い基本ステップが正味の反応速度に影響を与えます。
反応速度則は、素反応については、化学反応式から直接導き出すことができます。しかし多くの化学反応では、平衡式は多段階の反応機構に起因する化学系の全体的な変化を表すことが多いです。そのため、実験データから速度則を求め、そこから反応機構を推定する必要があります。
例えば、NO2とCOの反応を考えてみよう。
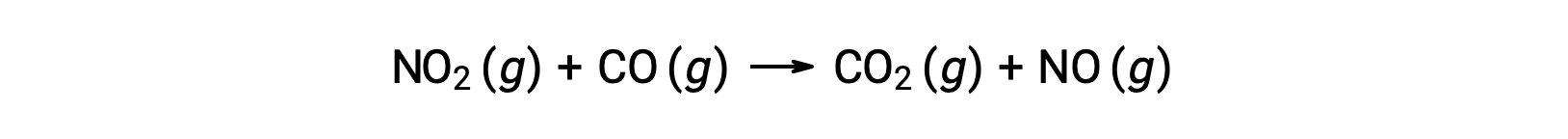
225 °C以上の温度でのこの反応の実験的な速度則は次のとおりです。

実験的な速度則によると、この反応はNO2に関しては一次、COに関しては一次であることがわかった。これは一段階の二分子機構と一致しており、この反応機構が高温で起こっていることを示唆しています。
一方で、225 °C以下の温度では、この反応はNO2に対して2次となる別の速度則で記述されます。
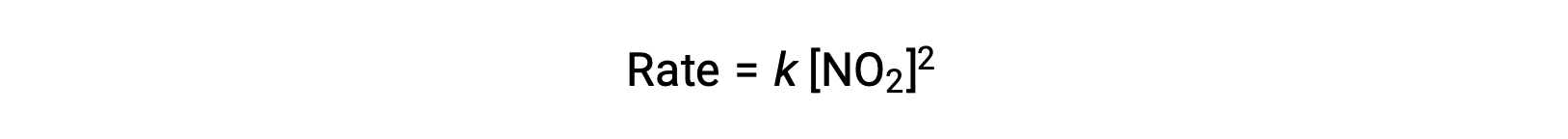
この速度則は、1ステップ反応のメカニズムとは一致しませんが、次のような2ステップ反応のメカニズムとは一致します。
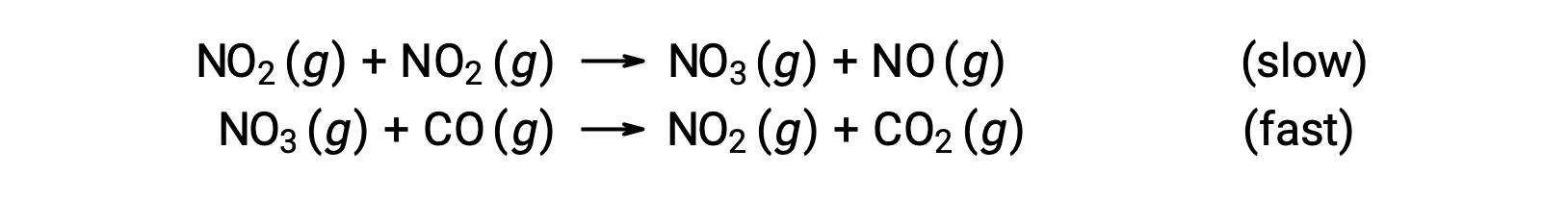
全体の反応速度を決定する遅いステップでは、NO2濃度に2次で依存する速度則が得られ、2つの素過程の和で全体の反応式が得られます。
一般に、反応速度を決めるステップ(遅いステップ)が反応機構の最初のステップである場合、反応全体の速度則はこの段階の速度則と同じになります。しかし、反応を決定するステップの前に急速な可逆反応を含むステップがある場合、反応中間体の存在が原因で、反応全体の速度則を導き出すのが難しくなることがあります。
このような場合には、「可逆反応は、正方向と逆方向の速度が等しいときに平衡状態にある」という概念を利用すればよいです。
例えば、NOが二量体化して中間種N2O2を生成する可逆的な素反応を考えます。この反応が平衡状態にあるとき、次のように表せます。
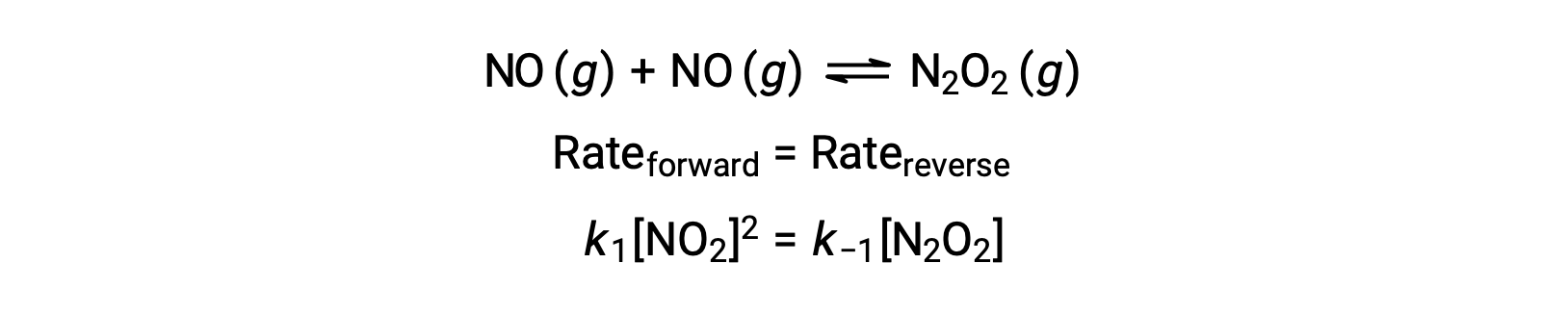
この式を並べ替えると、中間体の濃度を反応物であるNOで表すことができます。
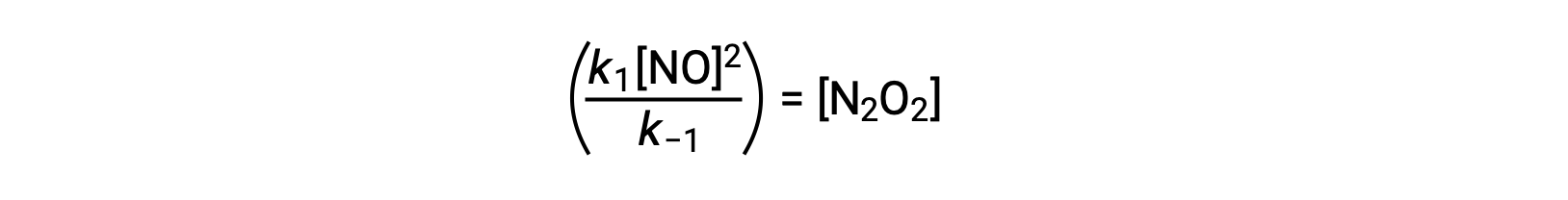
この手法は、反応中間体が存在する場合に全体的な反応の速度則を決める場合に利用できます。
反応機構から速度論を導く例
一酸化窒素と塩素分子の反応について、図のような2段階反応のメカニズムが提案されています。
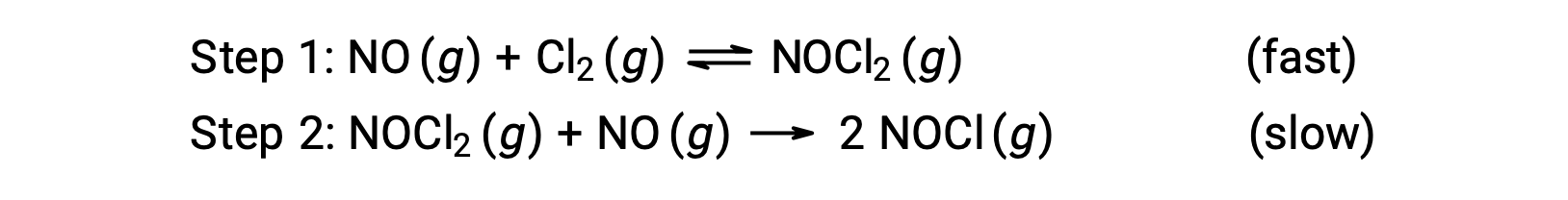
このメカニズムを利用して、全体の反応式から速度則を予測することができます。はじめに2つの素反応を足し合わせることで、全体の反応式が得られます。
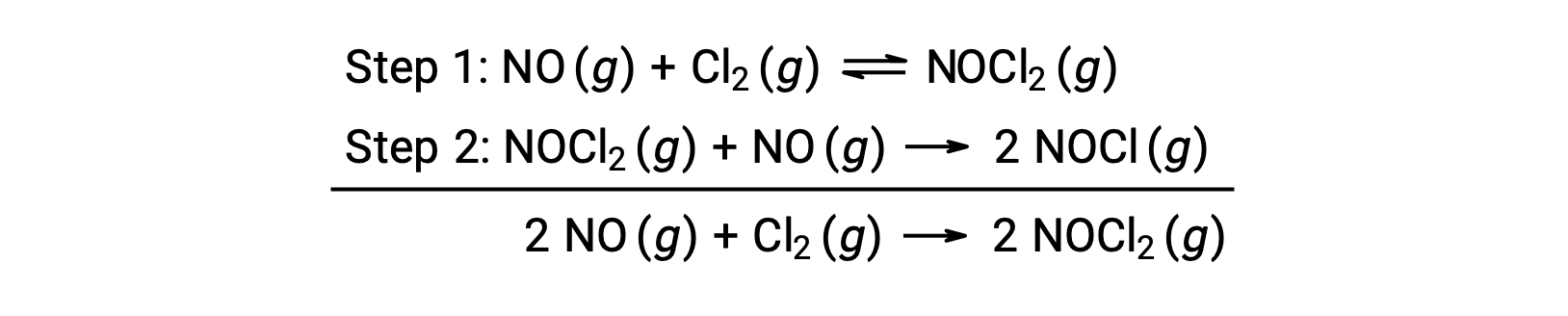
このメカニズムから速度則を導き出すには、2つの基本ステップそれぞれの速度則を書き下せばよいです。
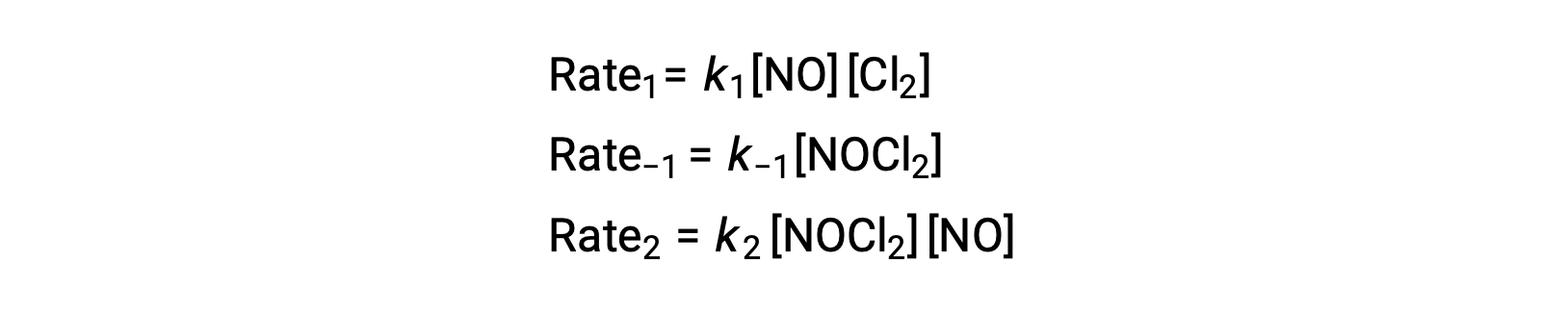
提案された反応機構によると、ステップ2は速度決定ステップです。したがって、全体の反応の速度則は、この素過程における速度則と同じになるはずです。しかし、ステップ2の速度則には、中間種濃度である[NOCl2]が含まれています。これを修正するために、最初の基本ステップの速度則を用いて、反応物の濃度から中間種濃度の式を求めます。
ステップ1が平衡状態にあると仮定すると、次のようになります。
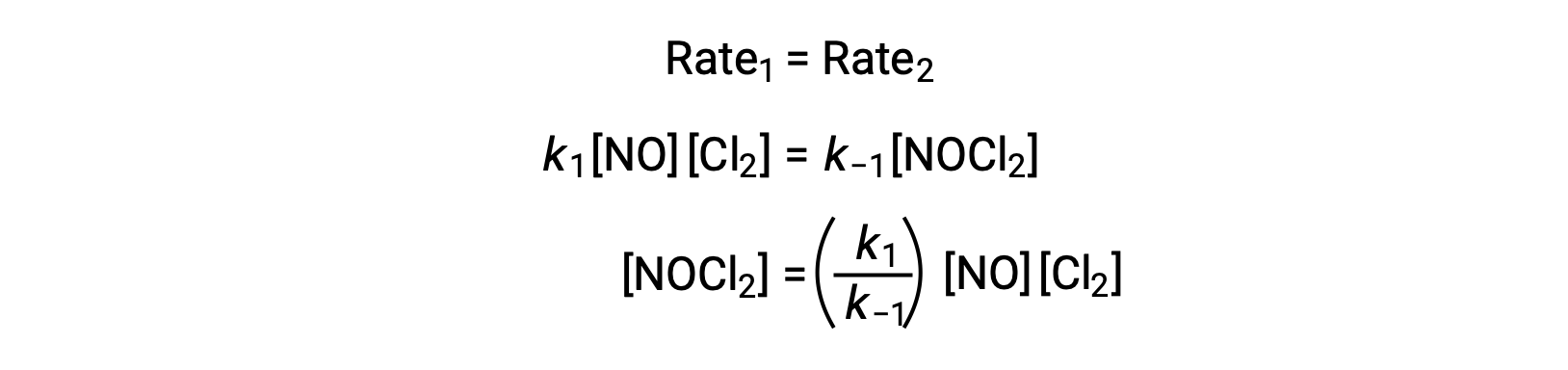
この式をステップ2の速度則に代入すると、次のようになります。
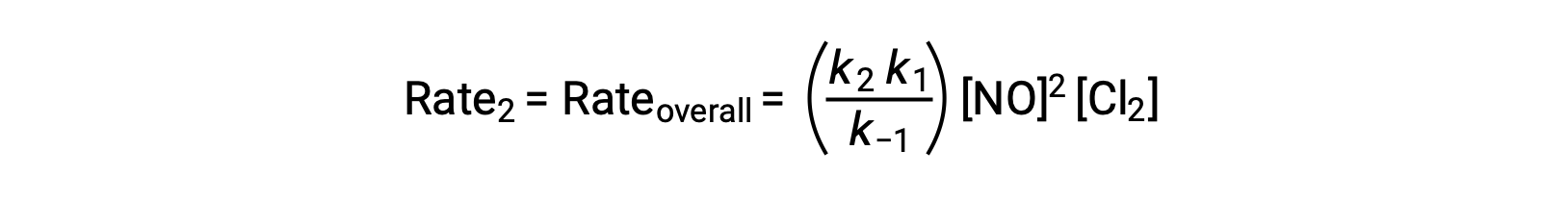
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 12.6: Reaction Mechanisms.
