13.9:
Mecanismos de Reacción
20,871 Views
•
•
Las reacciones químicas a menudo ocurren de manera gradual, involucrando dos o más reacciones distintas que ocurren en una secuencia. Una ecuación balanceada indica las especies que reaccionan y las especies del producto, pero no revela detalles sobre cómo ocurre la reacción a nivel molecular. El mecanismo de reacción (o trayectoria de reacción) proporciona detalles sobre el proceso preciso paso a paso por el que se produce una reacción.
Por ejemplo, la descomposición del ozono parece seguir un mecanismo de dos pasos:
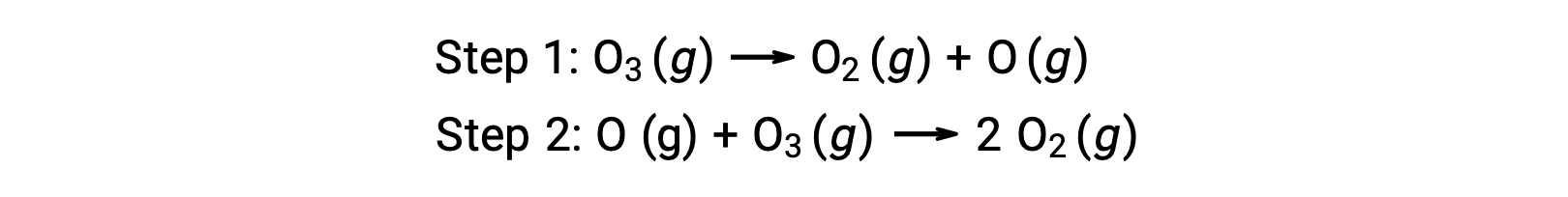
Cada uno de los pasos de un mecanismo de reacción se denomina reacción elemental. Estas reacciones elementales ocurren en secuencia, como se representan en las ecuaciones de pasos, y se suman para producir la ecuación química balanceada que describe la reacción general:
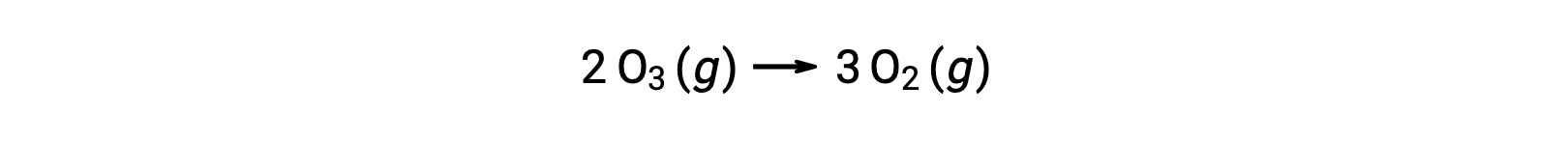
Observe que el átomo de oxígeno producido en el primer paso se consume durante el segundo y no aparece como un producto en la reacción general. Tales especies que se producen en un paso y se consumen en un paso posterior se llaman intermediarios de la reacción.
Mientras que la ecuación general de la reacción indica que dos moléculas de ozono reaccionan para producir tres moléculas de oxígeno, el mecanismo de reacción real no involucra la colisión y reacción directa de dos moléculas de ozono. En cambio, un O3 se descompone para producir O2 y un átomo de oxígeno, y una segunda molécula de O3 reacciona posteriormente con el átomo de oxígeno para producir dos moléculas adicionales de O2.
A diferencia de las ecuaciones balanceadas que representan una reacción general, las ecuaciones para las reacciones elementales son representaciones explícitas del cambio químico. Una ecuación de reacción elemental muestra el reactante real que está en proceso de ruptura/fabricación de enlaces, y el producto o productos formados. Por lo tanto, la ley de velocidad para una reacción elemental puede derivarse directamente de su ecuación química balanceada. Sin embargo, este no es el caso de las reacciones químicas típicas, para las cuales las leyes de velocidad pueden determinarse de manera fiable sólo a través de la experimentación.
Reacciones elementales unimoleculares
La molecularidad de una reacción elemental es el número de especies reactantes (átomos, moléculas o iones). Por ejemplo, una reacción unimolecular implica la reacción de un solo reactivo para producir una o más moléculas de producto:

La ley de velocidad para una reacción unimolecular es de primer orden; velocidad = k [A].
Una reacción unimolecular puede ser una de varias reacciones elementales en un mecanismo de reacción complejo. Por ejemplo, la reacción (O3 (g) → O2 (g) + O) ilustra una reacción elemental unimolecular que ocurre como parte de un mecanismo de reacción de dos pasos. Sin embargo, algunas reacciones unimoleculares pueden ser el único paso de un mecanismo de reacción de un solo paso. (En otras palabras, una reacción “general” puede ser también una reacción elemental en algunos casos.) Por ejemplo, la descomposición en fase gaseosa del ciclobutano, C4H8, al etileno, C2H4, se representa mediante la ecuación química:
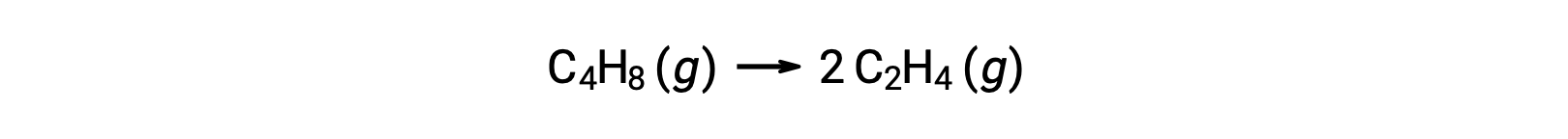
Esta ecuación representa la reacción general, describiendo un proceso elemental unimolecular. La ley de velocidad predicha a partir de esta ecuación, suponiendo que es una reacción elemental, resulta ser la misma que la ley de velocidad obtenida experimentalmente para la reacción general, mostrando un comportamiento de primer orden:
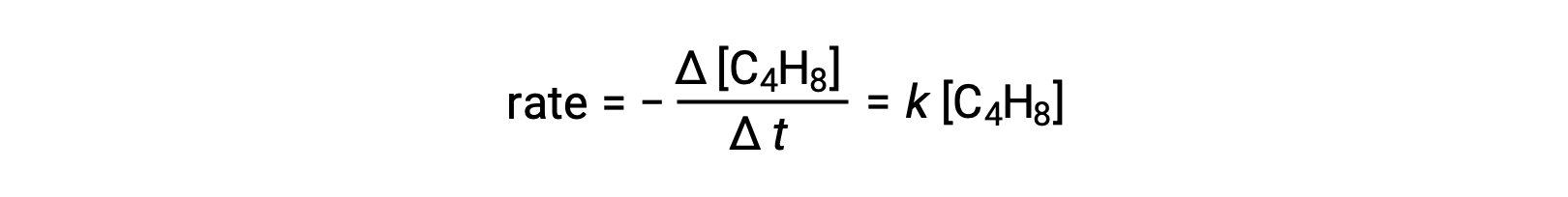
Este acuerdo entre las leyes de velocidad observadas y previstas indica que el proceso unimolecular propuesto en un solo paso es un mecanismo razonable para la reacción del butadieno.
Reacciones elementales bimoleculares
Una reacción bimolecular involucra dos especies reactantes. Por ejemplo:
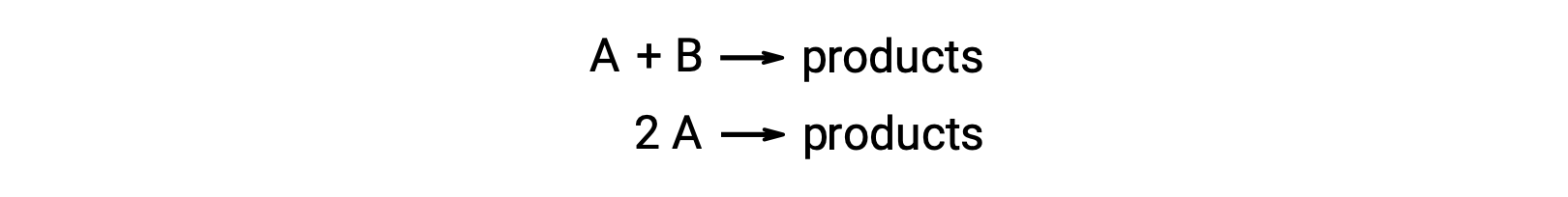
En el primer tipo, donde las dos moléculas de reactivo son diferentes, la ley de velocidad es de primer orden en A y de primer orden en B (en general de segundo orden)
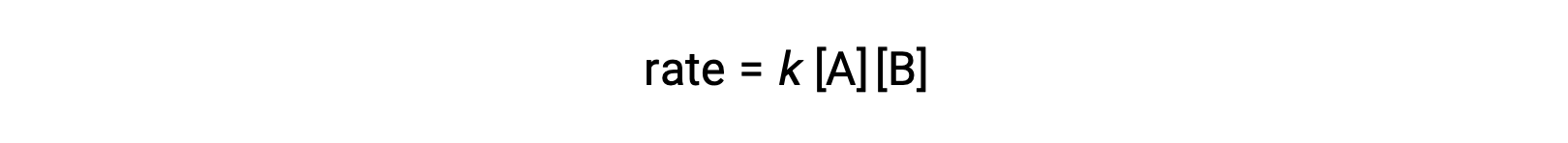
En el segundo tipo, en el que dos moléculas idénticas colisionan y reaccionan, la ley de velocidad es de segundo orden en A:
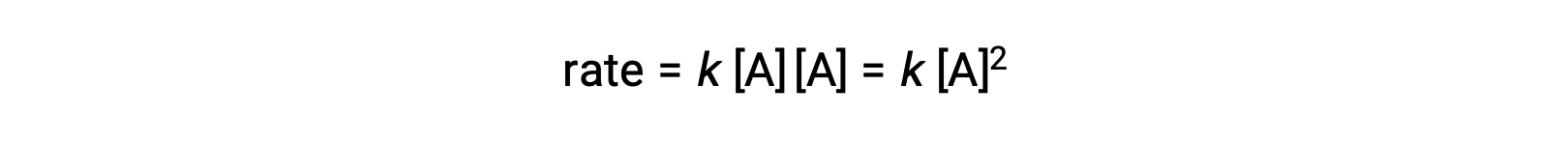
Algunas reacciones químicas ocurren por mecanismos que consisten en una sola reacción elemental bimolecular. Un ejemplo es la reacción del dióxido de nitrógeno con el monóxido de carbono:
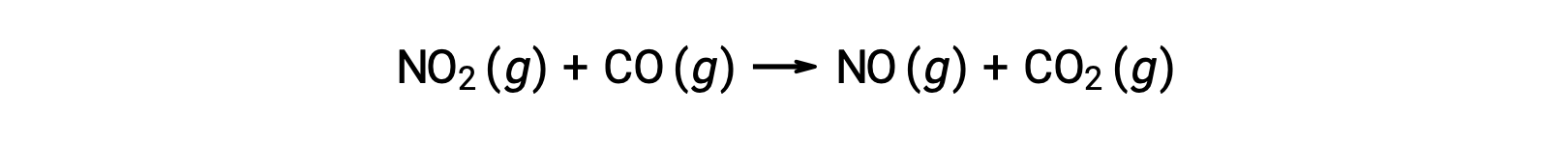
Las reacciones elementales bimoleculares también pueden estar involucradas como pasos en un mecanismo de reacción de varios pasos. La reacción del oxígeno atómico con el ozono es el segundo paso de un mecanismo de descomposición del ozono en dos pasos:
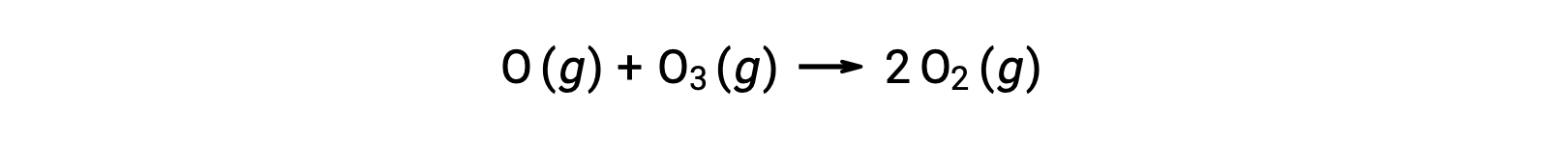
Reacciones elementales termoleculares
Una reacción termolecular elemental implica la colisión simultánea de tres átomos, moléculas o iones. Las reacciones elementales termoleculares son poco comunes porque la probabilidad de que tres partículas colisionen simultáneamente es muy rara. Sin embargo, existen algunas reacciones elementales termoleculares establecidas. La reacción del óxido nítrico con oxígeno parece implicar pasos termoleculares:
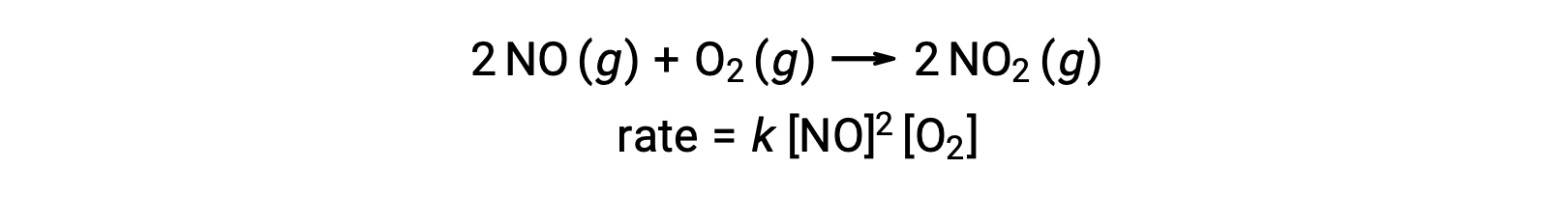
Asimismo, la reacción del óxido nítrico con el cloro parece implicar pasos termoleculares:
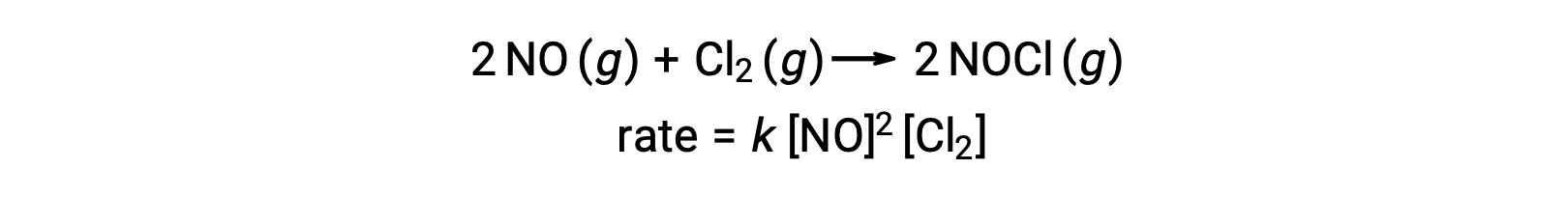
A menudo uno de los pasos elementales en un mecanismo de reacción de varios pasos es significativamente más lento que los otros. Debido a que una reacción no puede proceder más rápido que su paso más lento, este paso limitará la velocidad a la que se produce la reacción general. El paso elemental más lento se llama, por lo tanto, el paso de limitante de la velocidad (o paso determinante de la velocidad) de la reacción.
Este texto está adaptado de Openstax, Química 2e, 12.6: Mecanismos de reacción.
