13.9:
Mécanismes de réaction
20,871 Views
•
•
Les réactions chimiques se produisent souvent par étapes, impliquant deux ou plusieurs réactions distinctes se produisant de façon séquentielle. Une équation équilibrée indique les espèces qui réagissent et les espèces produites, mais elle ne révèle aucun détail sur la façon dont la réaction se produit au niveau moléculaire. Le mécanisme de la réaction (ou le chemin de la réaction) fournit des détails sur le processus par étape précis par lequel une réaction se produit.
Par exemple, la décomposition de l’ozone semble suivre un mécanisme en deux étapes :
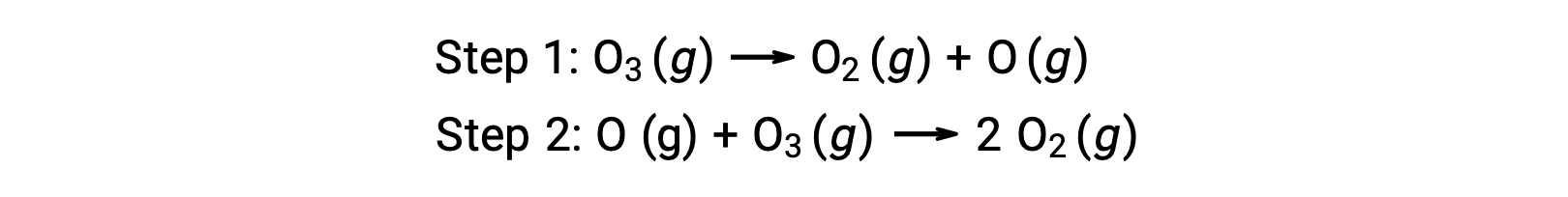
Chacune des étapes d’un mécanisme réactionnel est appelée une réaction élémentaire. Ces réactions élémentaires se produisent dans l’ordre, comme représenté dans les équations des étapes, et elles s’additionnent pour donner l’équation chimique équilibrée décrivant la réaction globale :
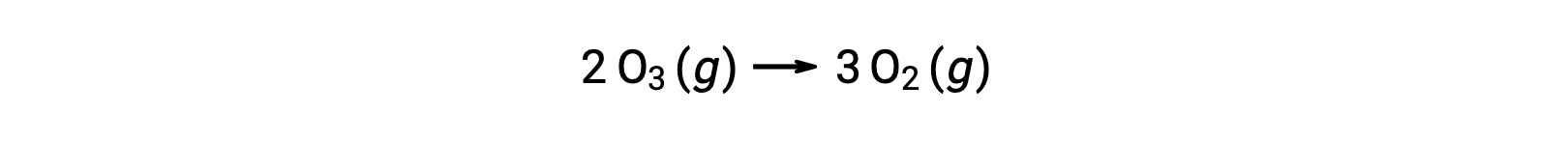
Notez que l’atome d’oxygène produit dans la première étape est consommé pendant la seconde et n’apparaît pas comme un produit dans la réaction globale. De telles espèces qui sont produites à une étape et consommées à la suivante sont appelées des intermédiaires de réaction.
Bien que l’équation de réaction globale indique que deux molécules d’ozone réagissent pour donner trois molécules d’oxygène, le mécanisme réactionnel réel n’implique pas la collision directe et la réaction de deux molécules d’ozone. Au lieu de cela, un O3 se décompose pour produire O2 et un atome d’oxygène, et une deuxième molécule d’O3 réagit ensuite avec l’atome d’oxygène pour produire deux molécules d’O2 supplémentaires.
Contrairement aux équations équilibrées représentant une réaction globale, les équations pour les réactions élémentaires sont des représentations explicites de la transformation chimique. Une équation de réaction élémentaire représente le ou les réactifs réels en cours de rupture/formation de liaison et le ou les produits formés. Ainsi, la loi de vitesse d’une réaction élémentaire peut être déduite directement à partir de son équation chimique équilibrée. Toutefois, ce n’est pas le cas pour les réactions chimiques typiques, pour lesquelles les lois de vitesse peuvent être déterminées de manière fiable uniquement par expérimentation.
Réactions élémentaires unimoléculaires
La molécularité d’une réaction élémentaire est le nombre d’espèces qui réagissent (atomes, molécules ou ions). Par exemple, une réaction unimoléculaire implique la réaction d’un seul réactif pour produire une ou plusieurs molécules de produit :

La loi de vitesse pour une réaction unimoléculaire est du premier ordre ; vitesse = k [A].
Une réaction unimoléculaire peut être l’une des diverses réactions élémentaires d’un mécanisme de réaction complexe. Par exemple, la réaction (O3 (g) → O2 (g) + O) illustre une réaction élémentaire unimoléculaire qui fait partie d’un mécanisme de réaction en deux étapes. Cependant, certaines réactions unimoléculaires peuvent être la seule étape d’un mécanisme de réaction en une seule étape (en d’autres termes, une réaction “ globale ” peut aussi être une réaction élémentaire dans certains cas). Par exemple, la décomposition en phase gazeuse du cyclobutane, C4H8, en éthylène, C2H4, est représentée par l’équation chimique :
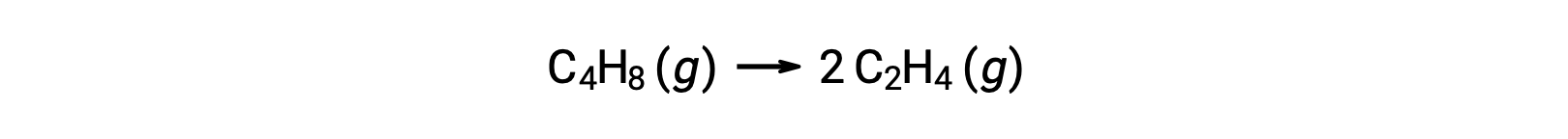
Cette équation représente la réaction globale, décrivant un processus élémentaire unimoléculaire. La loi de vitesse prédite à partir de cette équation, en supposant qu’il s’agit d’une réaction élémentaire, s’avère être la même que la loi de vitesse déduite expérimentalement pour la réaction globale, montrant un comportement du premier ordre:
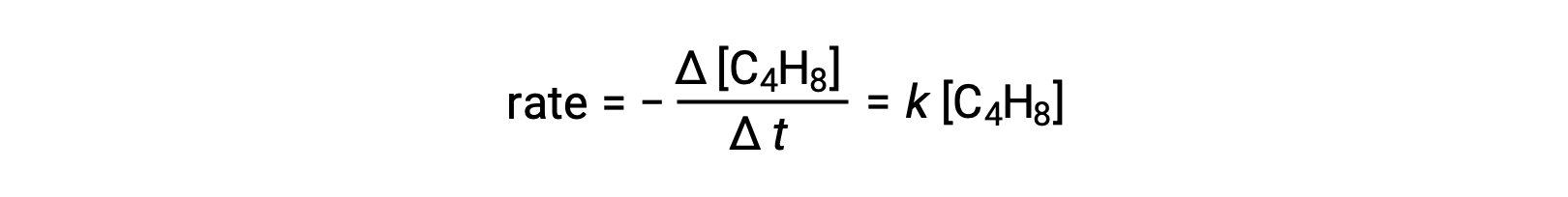
Cet accord entre les lois de vitesse observée et prédite indique que le processus unimoléculaire proposé en une seule étape est un mécanisme raisonnable pour la réaction du butadiène.
Réactions élémentaires bimoléculaires
Une réaction bimoléculaire implique deux espèces qui réagissent. Par exemple :
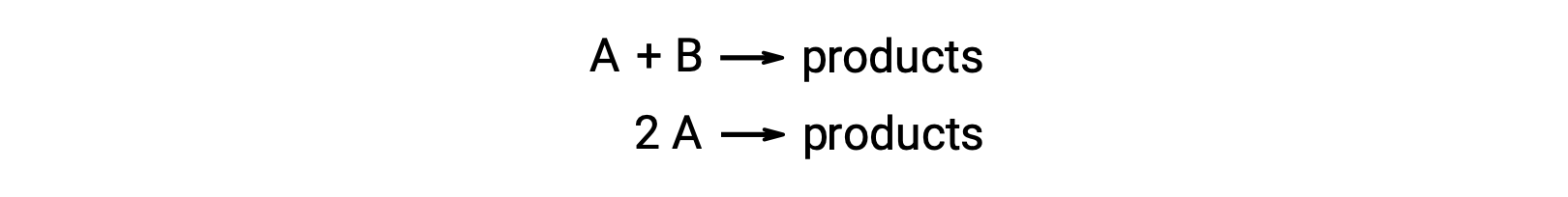
Dans le premier type, où les deux molécules qui réagissent sont différentes, la loi de vitesse est du premier ordre en A et du premier ordre en B (du deuxième ordre global)
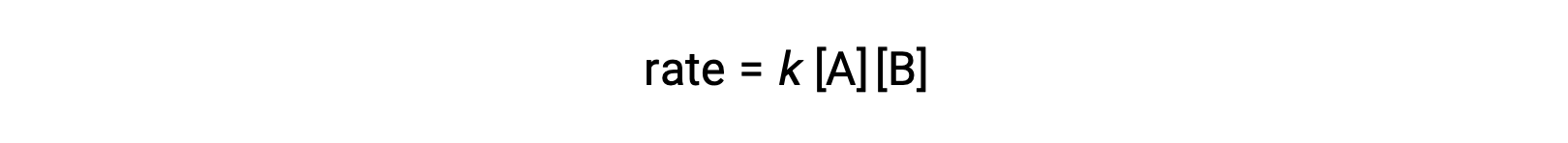
Dans le second type, dans lequel deux molécules identiques entrent en collision et réagissent, la loi de vitesse est du deuxième ordre en A :
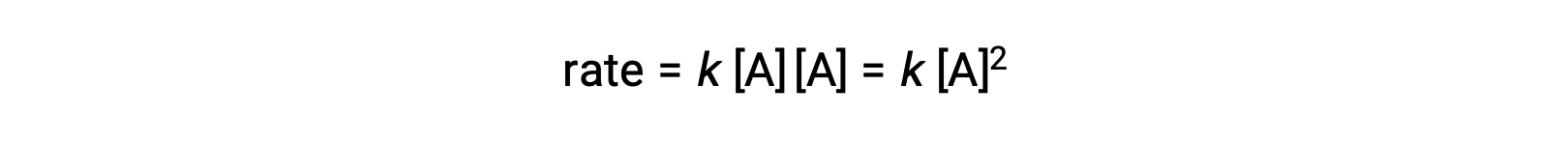
Certaines réactions chimiques se produisent par des mécanismes qui consistent en une seule réaction élémentaire bimoléculaire. Un exemple est la réaction du dioxyde d’azote avec le monoxyde de carbone :
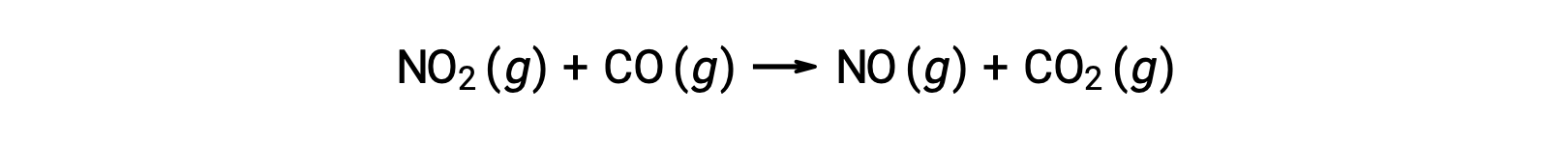
Les réactions élémentaires bimoléculaires peuvent également être impliquées comme des étapes dans un mécanisme de réaction en plusieurs étapes. La réaction de l’oxygène atomique avec l’ozone est la seconde étape d’un mécanisme de décomposition de l’ozone en deux étapes :
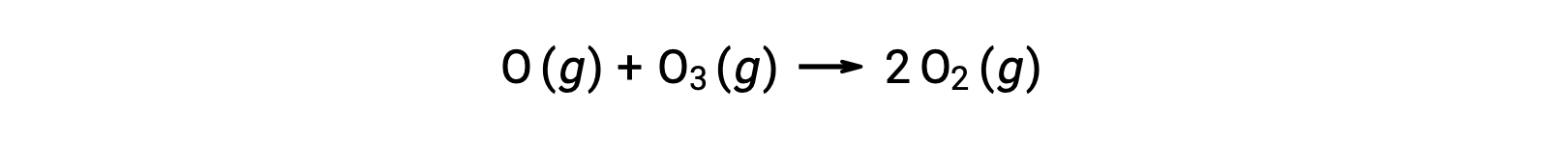
Réactions élémentaires termoléculaires
Une réaction élémentaire termoléculaire implique la collision simultanée de trois atomes, molécules ou ions. Les réactions élémentaires termoléculaires sont rares car la probabilité de collision simultanée de trois particules est très rare. Il existe toutefois quelques réactions élémentaires termoléculaires établies. La réaction de l’oxyde nitrique avec l’oxygène semble impliquer des étapes termoléculaires :
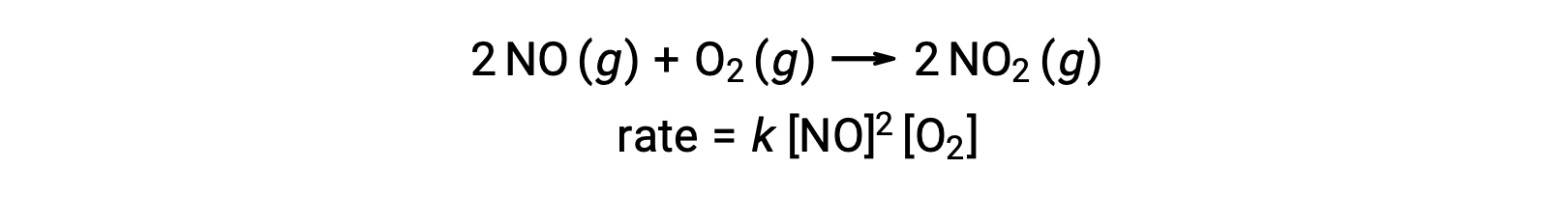
De même, la réaction de l’oxyde nitrique avec le chlore semble impliquer des étapes termoléculaires :
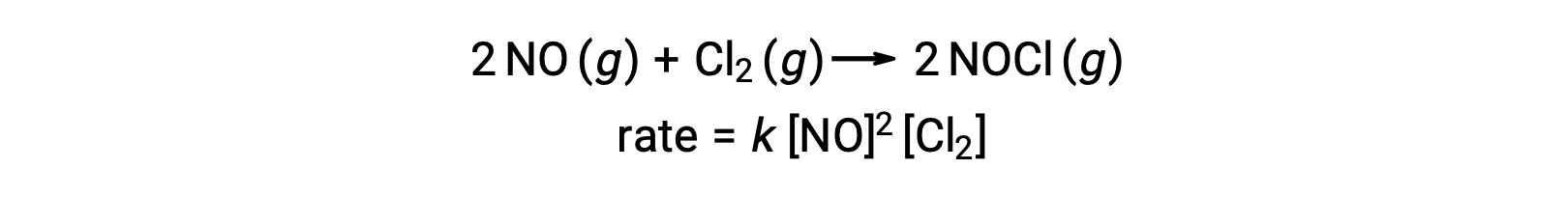
Souvent, l’une des étapes élémentaires d’un mécanisme de réaction en plusieurs étapes est beaucoup plus lente que les autres. Comme une réaction ne peut pas se poursuivre plus rapidement que son étape la plus lente, cette étape limitera la vitesse à laquelle la réaction globale se produit. L’étape élémentaire la plus lente est donc appelée étape limitante de la vitesse (ou étape déterminante de la vitesse) de la réaction.
Ce texte est adapté de Openstax, Chimie 2e, 12.6 : Mécanismes de réaction.
