13.6:
反应半衰期
29,685 Views
•
•
反应半衰期 (T1/2) 是指定反应物数量的一半要消耗的时间。 在接下来的每一个半衰期中,反应物剩余浓度的一半都被消耗。 例如,在过氧化氢分解期间,在第一个半衰期 (从 0.00 小时到 6.00 小时) , H2O2 的浓度从 1000 M 降至 0.500 M。 在第二个半衰期 (从 6.00 小时到 12.00 小时) ,浓度从 0.500 M 降至 0.250 M , 在第三个半衰期内, H2O2 的浓度从 0.250 M 下降到 0.125 M H。
一阶反应的半衰期与反应物的浓度无关。 然而,与其他处方反应的半衰期取决于反应物的浓度。
一阶反应的半衰期
将一阶反应的半衰期与其率值常数相关的方程可从其积分速率定律导出:
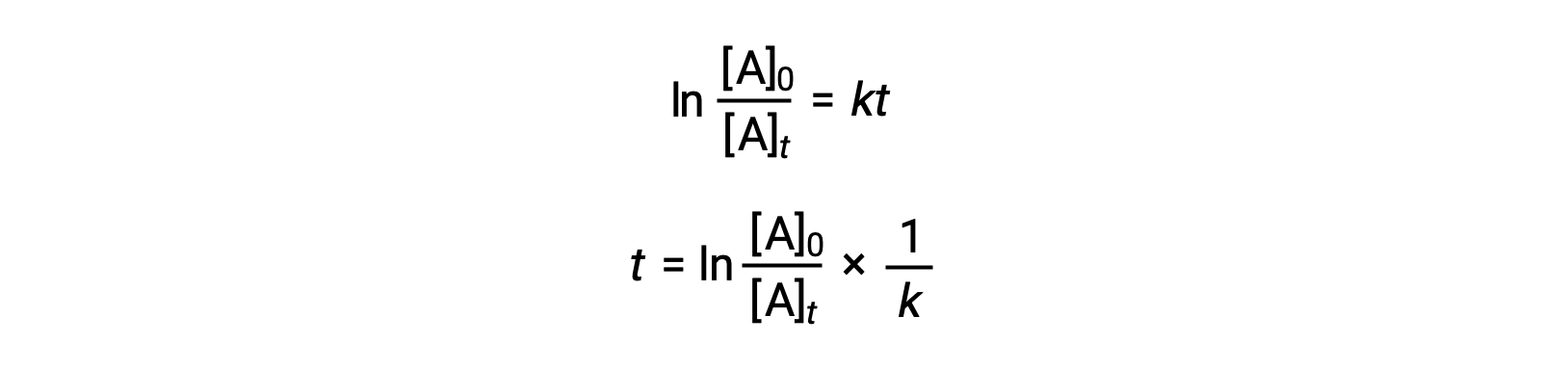
根据半衰期的定义,在时间为 T1/2 时,反应物 A 的浓度是其初始浓度的一半。 因此, t = t1/2 和 [a]t = ½ [a]0。
将这些条款替换为重新排列的积分速率定律并简化产率 the 方程的半衰期:
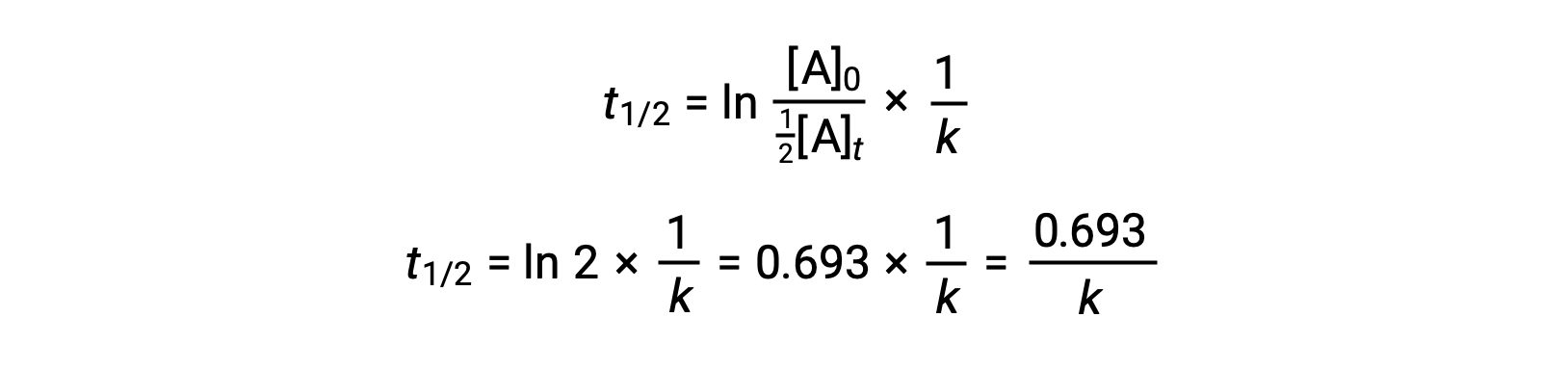
这种半衰期方程描述了反应半衰期与其率值常量 K. 之间的预期反向关系 更快的反应表现出更大的率值常量,相应地缩短了半衰期,而较慢的反应表现出更小的率值常量和更长的半衰期。
二级反应的半衰期
按照与一阶反应相同的方法,方程将二阶反应的半衰期与其率值常数和初始浓度相关,可从其积分速率定律导出:
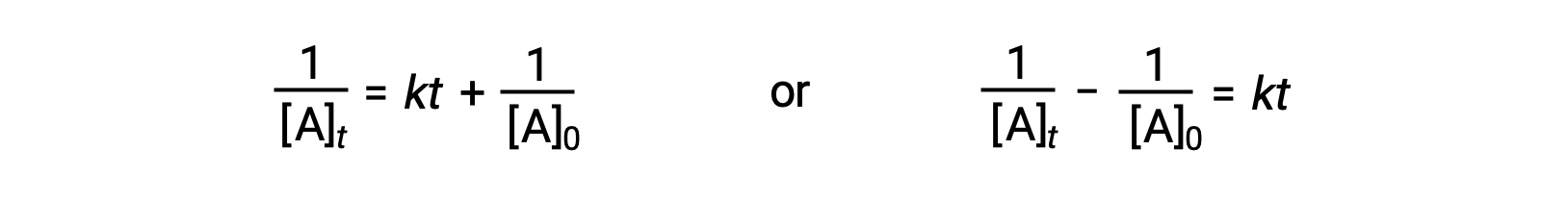
在替换 t = t1/2 和 [a]t = ½ [a]0 时,积分速率定律将被简化:
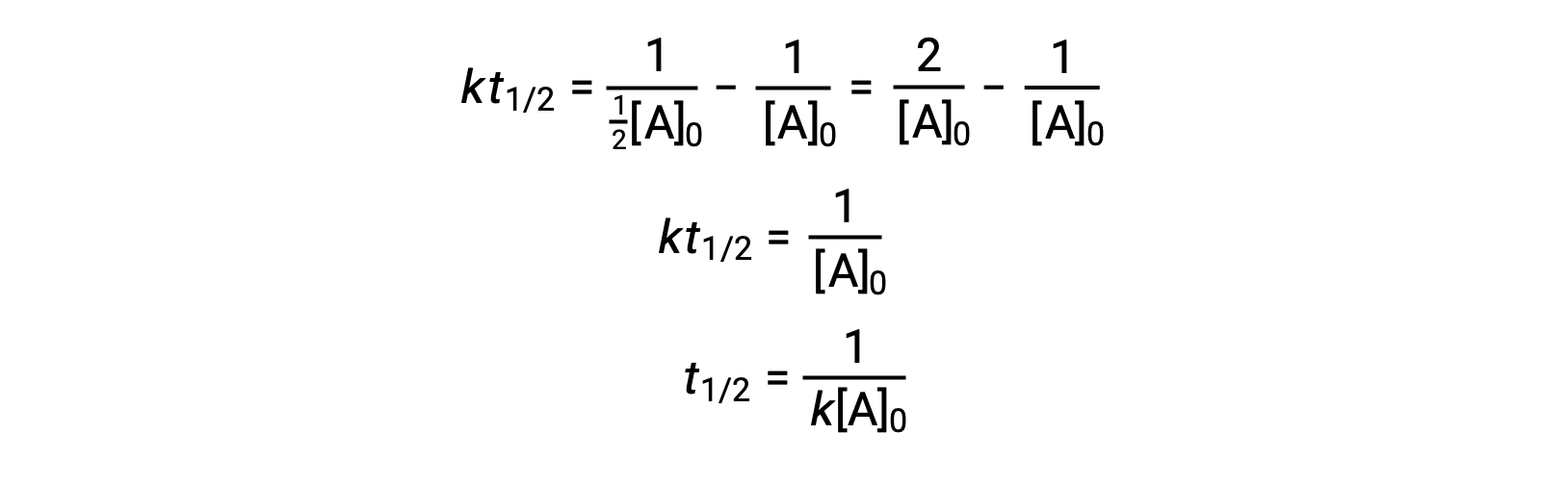
对于二级反应, T1/2 与反应物的浓度成反比,随着反应的进行,半衰期会增加,因为反应物的浓度会下降。 与一阶反应不同,二阶反应的率值常数不能直接从半衰期计算,除非已知初始浓度。
零阶反应的半衰期
零次序半衰期的方程也可以从其积分速率定律中派生:
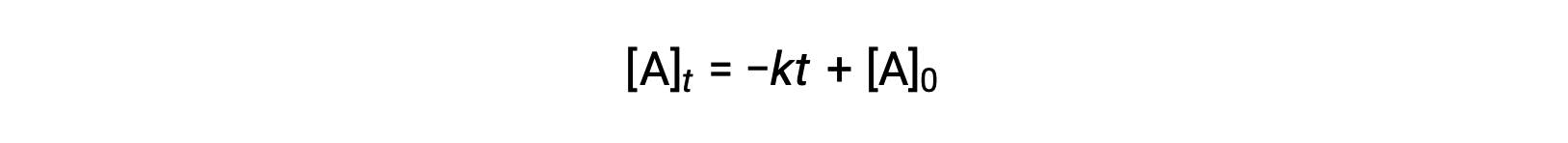
在 零阶积分速率定律产率中替换 t = t1/2 和 [a]t = ½ [a]0 :
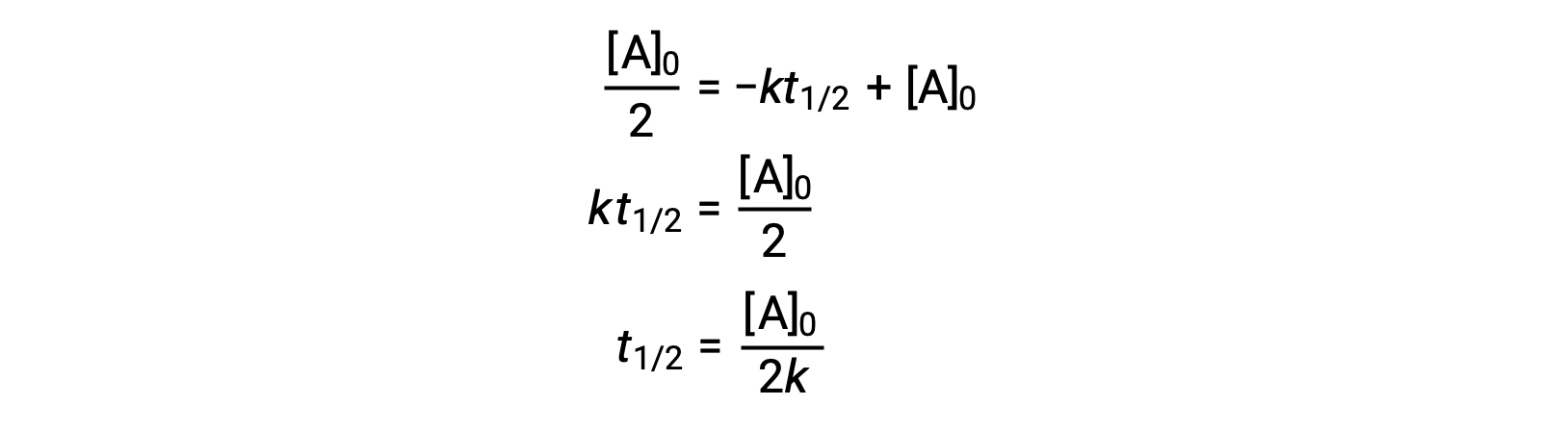
零阶反应的半衰期与其率值常数成反比。 但是,随着初始浓度的增加,零阶反应的半衰期会增加。
