13.4:
Определение порядка реакции
48,517 Views
•
•
Законы скорости описывают взаимосвязь между скоростью химической реакции и концентрацией реагентов. В законе о скорости константа скорости k и порядки реакции определяются экспериментально путем наблюдения за изменением скорости реакции по мере изменения концентраций реагенты. Общий экспериментальный подход к определению норм внесения является методом начальных ставок. Этот метод включает в себя измерение скорости реакции для нескольких экспериментальных исследований, проведенных с использованием различных начальных концентраций реагент. Сравнение измеренных ставок для этих испытаний позволяет определить порядок действий и, впоследствии, константу ставок, которая вместе используется для формулирования закона ставок.
Скорость реакции, например, с участием оксида азота с озоном [NO (g) + O3 (g) ⟶ NО2 (g) + O2 (g)], может быть определена на основе экспериментальных данных метода начальных скоростей, в лаборатории.
| Trial | [NO] (mol/L) | [O3] (mol/L) | Δ[NО2]/Δt (mol/L·s) |
| 1 | 1.00 × 10−6 | 3.00 × 10−6 | 6.60 × 10−5 |
| 2 | 1.00 × 10−6 | 6.00 × 10−6 | 1.32 × 10−4 |
| 3 | 1.00 × 10−6 | 9.00 × 10−6 | 1.98 × 10−4 |
| 4 | 2.00 × 10−6 | 9.00 × 10−6 | 3.96 × 10−4 |
| 5 | 3.00 × 10−6 | 9.00 × 10−6 | 5.94 × 10−4 |
From the rate data, a generic rate law; rate = k[NO]m[O3]n is formulated. The values of the reaction orders m and n, and rate constant k are determined from the experimental data using a three-part process:
In step 1, the value of m is determined from the data in which [NO] varies, and [O3] is constant. In trials 3, 4 and 5, [NO] varies while [O3] remains constant. When [NO] doubles from trial 3 to 4, the rate doubles, and when [NO] triples from trial 3 to 5, the rate also triples. Thus, the rate is also directly proportional to [NO], and m in the rate law is equal to 1.
In step 2, the value of n is determined from data in which [O3] varies, and [NO] is constant. In trials 1,2 and 3, [NO] is constant and [O3] varies. The reaction rate changes in direct proportion to the change in [O3]. When [O3] doubles from trial 1 to 2, the rate doubles; when [O3] triples from trial 1 to 3, the rate increases also triples. Thus, the rate is directly proportional to [O3], and n is equal to 1. The rate law is thus: rate = k [NO]1 [O3]1 = k [NO][O3]
In step 3, the value of k is determined from one set of concentrations (for instance, the data from trial 1) and its corresponding rate.
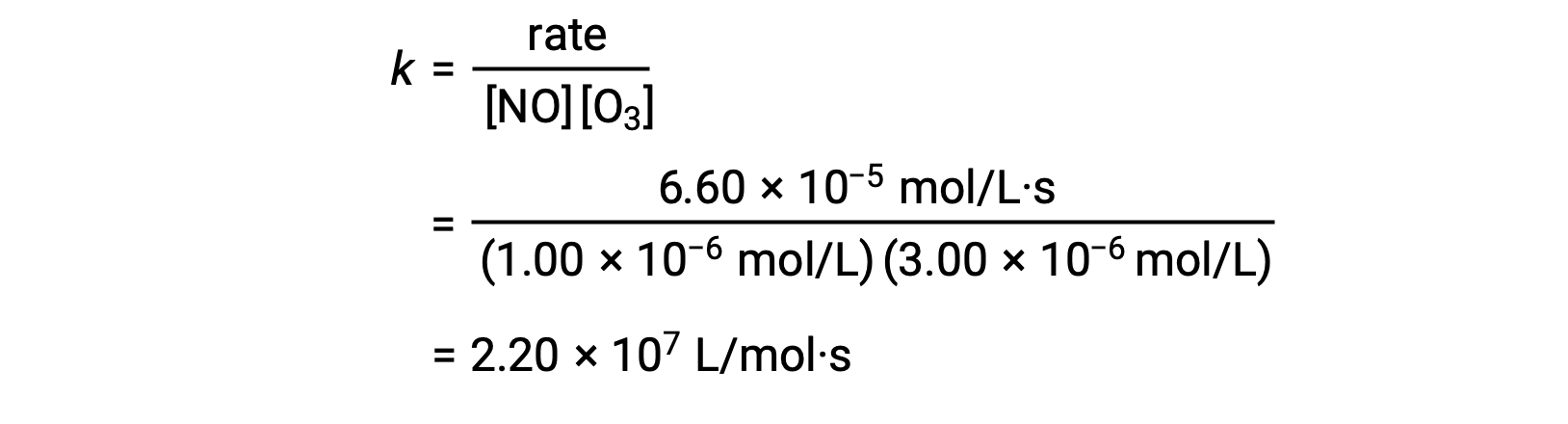
In reactions where the data from the method of initial rates does not directly imply the relation between initial concentrations and initial rates, a calculation involving the ratio of rate laws can be employed to calculate the reaction order and rate constant.
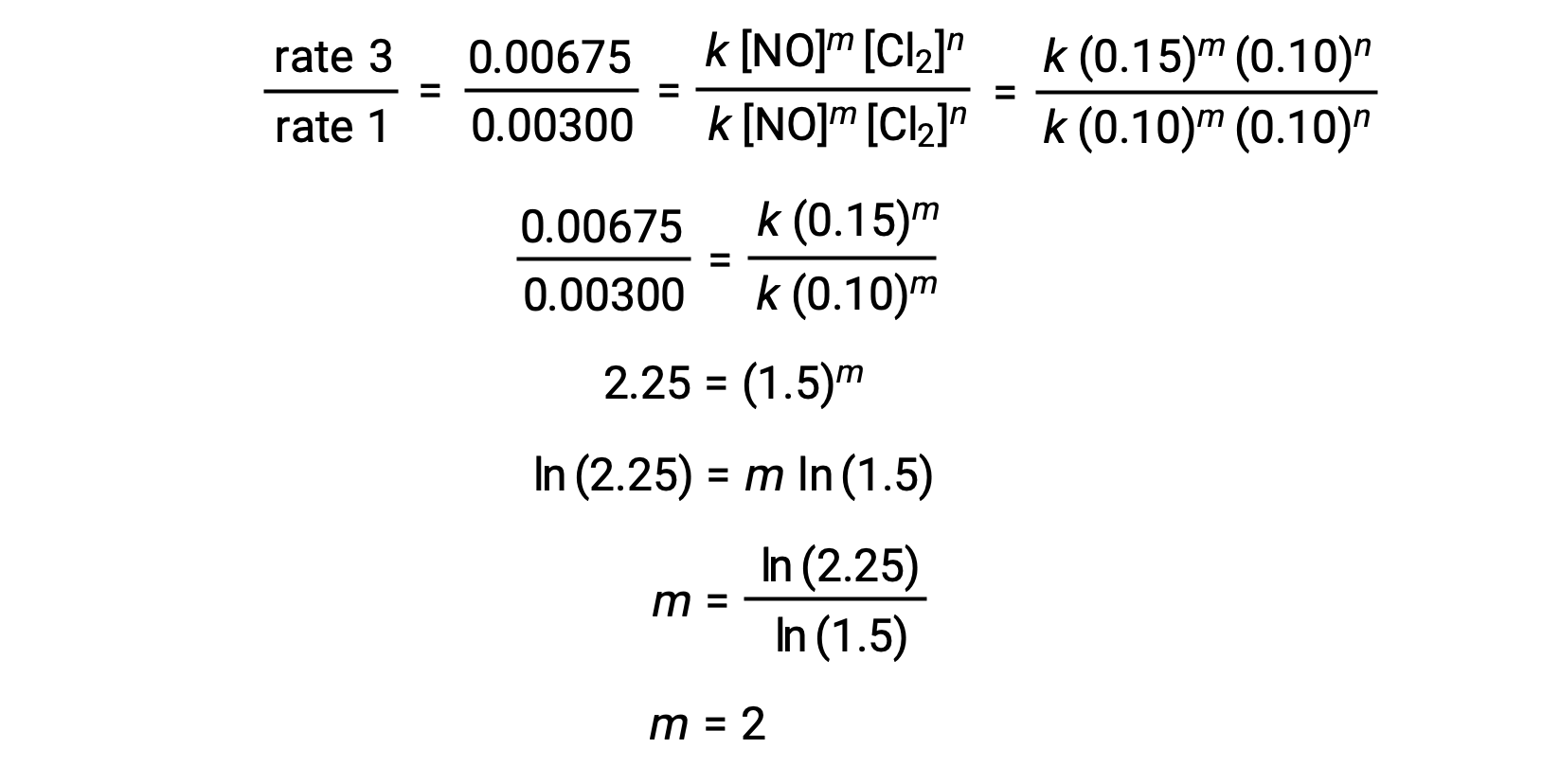
For example, the general rate law for the reaction 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) is expressed as: rate = k [NO]m [Cl2]n.
The data from the method of initial rates are:
| Эксперимент | [NO] (моль/л) | [CL2] (моль/л) | Начальная скорость (моль/л·с) |
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
Значения m и n могут быть определены на основе экспериментальных данных с помощью алгебраического подхода, после чего определяется значение k.
На шаге 1 значение m определяется из данных, в которых изменяется [NO] и [Cl2] является постоянным. Соотношение законов о процентной ставке выражается заменой данных двух разных судебных процессов (например, суд 3 и суд 1).
На шаге 2 значение n определяется на основании данных, в которых изменяется [Cl2], и [NO] является постоянным.
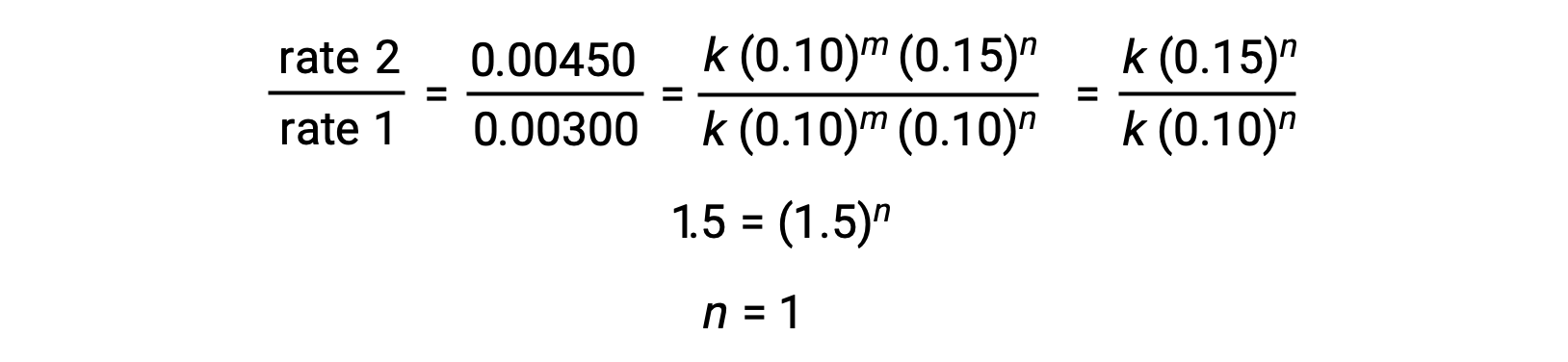
С помощью вычисленных значений m и n закон нормы выражается как ставка = k [НЕТ]2 [К2].
На шаге 3 числовое значение константы расхода k определяется соответствующими единицами измерения. Единицами измерения скорости реакции являются моль/л. ·Единицы для k заключаются путем замены единиц всех других параметров в законе ставок. В данном примере единицы концентрации — mol3/L3. Единицы измерения k должны быть L2/mol2·s, чтобы скорость была в моль/л. ·Значение k определяется после того, как выражение закона нормы внесения было решено путем простого подстановки значений в ходе любого из экспериментальных испытаний (например, судебного разбирательства 1).
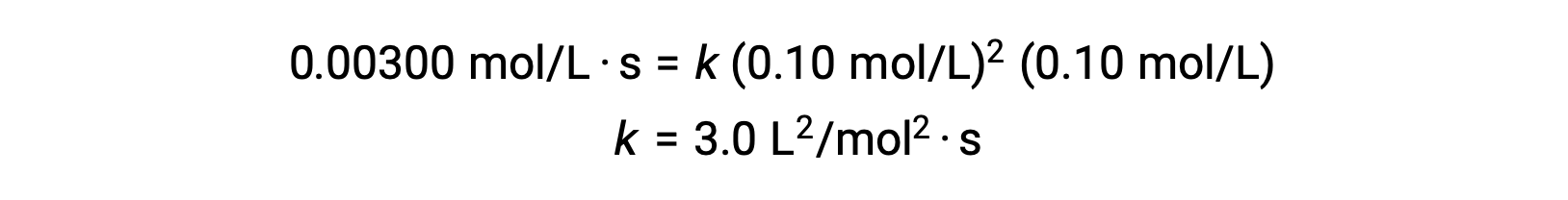
Порядок реакции и Единицы постоянной скорости
В некоторых реакциях порядки реакции в норме нормы происходят так же, как и коэффициенты в химическом уравнении для реакции. Это просто совпадение, и очень часто это не так. Законы о норме могут представлять дробные приказы для некоторых реагенты, а иногда при увеличении концентрации одного реагент происходит снижение скорости реакции. Законы о тарировании определяются только экспериментом и не могут быть надежно предсказаны стехиометрией реакции.
Единицы измерения постоянной скорости будут изменяться в зависимости от общего порядка реакции. Единица постоянной скорости для реакции нулевого порядка — моль/л·с (или м/с) и то, что для реакции первого порядка — 1/с. Единица постоянной скорости реакции второго порядка — л/моль·с (или 1/м·с), а для реакции третьего порядка — L2/mol2·с. Хотя конкретные единицы концентрации и времени указаны как (моль/л) и (с), для представления свойств концентрации и времени можно использовать любые другие допустимые единицы.
Этот текст был адаптирован к Openstax, Chemistry 2e, раздел 12.3: Законы о тарифе.
