9.13:
Энергия связи и длина связи
22,507 Views
•
•
Стабильные молекулы существуют, потому что ковалентные связи удерживают атомы вместе. Прочность ковалентной связи измеряется энергией, необходимой для ее разрыва, то есть энергией, необходимой для разделения связанных атомов. Разделение любой пары связанных атомов требует энергии — чем сильнее связь, тем больше энергии требуется для ее разрыва.
Энергия, необходимая для разрыва определенной ковалентной связи в одном моль молекул газа, называется энергией связи или энергией диссоциации связи. Энергия связи для двухатомной молекулы, DX–Y, определяется как стандартное изменение энтальпии эндотермической реакции:
Например, энергия связи чистой ковалентной H–H связи, DH–H, составляет 436 кДж/моль разрыва H–H связей:
Молекулы с тремя или более атомами имеют две или более связи. Сумма всех энергий связи в такой молекуле равна стандартному изменению энтальпии эндотермической реакции, которая разрывает все связи в молекуле. Например, сумма четырех энергий связи с C–H в CH4, 1660 кДж, равна стандартной энтальпии изменения реакции:
Средняя энергия связи C–H, DC–H, составляет 1660/4 = 415 кДж/моль, так как на каждый моль реакции разрыва четырёх связей C–H . Несмотря на то, что четыре связи C–H эквивалентны в исходной молекуле, они не требуют одинаковой энергии для разрыва; после разрыва первой связи (для которой требуется 439 кДж/моль), оставшиеся связи легче разорвать. Среднее значение 415 кДж/моль, а не точное значение, необходимое для разрыва одной связи.
Прочность связи между двумя атомами увеличивается по мере увеличения числа пар электронов в связи. Как правило, по мере увеличения прочности связки длина связки уменьшается. Таким образом, тройные связи сильнее и короче, чем двойные связи между двумя атомами; аналогично, двойные связи сильнее и короче, чем одиночные связи между теми же двумя атомами. Когда один атом связен с различными атомами в группе, прочность связи обычно уменьшается по мере того, как мы перемещаемся вниз по группе. Например, C–F составляет 439 кДж/моль, C–CL — 330 кДж/моль, а C–br — 275 кДж/моль.
Энергии связи можно использовать для расчета приблизительных изменений энтальпии реакций, также называемых энтальпиями связи, где энтальпия образования отсутствует. Расчеты этого типа также показывают, является ли реакция экзотермической или эндотермической. Экзотермическая реакция (ΔH отрицательная, выделяющая тепло) приводит к более сильным связям в продуктах, чем связи в реагентах. Эндотермическая реакция (ΔH положительная, тепло поглощается) приводит к ослаблению связей в продуктах по сравнению с реагентами.
Изменение энтальпии, ΔH, для химической реакции, приблизительно равно сумме энергии, необходимой для разрыва всех связей в реагенте (знак энергии “внутрь”, положительная) плюс энергия, выделенная при создании всех связей в продуктах (знак энергии “наружу”, отрицательная). Математически это можно выразить следующим образом:
В этом выражении символ ∑ означает “сумму”, а D – энергию связи в кДж/моль, которая всегда является положительным числом. Энергия связей будет зависеть от того, является ли конкретная связь одинарной, двойной или тройной. Таким образом, при расчете энтальпий таким образом важно учитывать связывание во всех продуктах реагенты. Поскольку значения D обычно представляют собой средние значения для одного типа связи во многих различных молекулах, этот расчет дает приблизительную оценку, а не точное значение энтальпии реакции.
Рассмотрим следующую реакцию:
или
Для образования двух молей HCl необходимо разорвать один моль связей H & ndash; H и один моль связей Cl & ndash; Cl. Энергия, необходимая для разрыва этих связей, представляет собой сумму энергии связи H-H-связи (436 кДж / моль) и Cl-Cl-связи (243 кДж / моль). Во время реакции образуются два моля связей H & ndash; Cl (энергия связи = 432 кДж / моль), высвобождая 2 & раза; 432 кДж; или 864 кДж. Поскольку связи в продуктах сильнее, чем в реагентах, реакция выделяет больше энергии, чем потребляет:

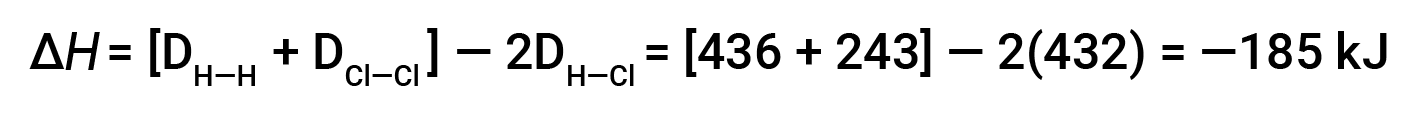
Эта избыточная энергия выделяется как тепло, поэтому реакция является экзотермической.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 7.5: Прочность связи: Ковалентные связи.
