7.11:
Orbitais Atômicos
27,733 Views
•
•
Uma orbital atómica representa as regiões tridimensionais de um átomo onde um eletrão tem a maior probabilidade de residir. A função de distribuição radial indica a probabilidade total de encontrar um eletrão dentro da fina camada a uma distância r do núcleo. As orbitais atómicas têm formas distintas que são determinadas por l, o número quântico do momentum angular. As orbitais são frequentemente desenhadas com uma superfície de limite, envolvendo as regiões mais densas da nuvem.
O número quântico do momentum angular é um número inteiro que pode ter os valores, l = 0, 1, 2, …, n – 1. Uma orbital com um número quântico principal de 1 (n = 1) pode ter apenas um valor de l (l = 0), enquanto que um número quântico principal de 2 (n = 2) permite l = 0 e l = 1. Orbitais com o mesmo valor de l definem uma subcamada.
As orbitais com l = 0 são chamadas orbitais s e formam as subcamadas s. O valor l = 1 corresponde às orbitais p. Para um determinado n, as orbitais p constituem uma subcamada p (isto é, 3p se n = 3). As orbitais com l = 2 são chamadas de orbitais d. As orbitais com l = 3, 4, e 5 são as orbitais f, g, e h.
A orbital de menor energia é a orbital 1s. Trata-se de uma orbital esfericamente simétrica. A densidade de probabilidade (ψ2) de uma orbital 1s implica que é mais provável encontrar o eletrão no núcleo. No entanto, dadas as forças eletrostáticas entre protões e eletrões, isto não representa com precisão o local onde o eletrão reside. Em vez disso, é utilizada a Função de Distribuição Radial, que é um gráfico da probabilidade total de encontrar um eletrão em uma orbital em um determinado raio r. A função de distribuição radial é encontrada multiplicando a densidade de probabilidade pelo volume de camadas esféricas finas com raios, r. Para a orbital 1s do hidrogénio, a Função de Distribuição Radial tem um valor de zero no núcleo, que aumenta até ao máximo de 52,9 picómetros antes de diminuir com o aumento do r.
Existem algumas distâncias do núcleo em que a densidade de probabilidade de encontrar um eletrão localizado em uma orbital específica é zero. Por outras palavras, o valor da função de onda ψ é zero a essa distância para essa orbital. Esse valor de r é chamado de nó radial. O número de nós radiais em uma orbital é n – l – 1. Para orbitais 2s, onde n = 1, há um nó radial, enquanto que orbitais 3s têm dois nós radiais.
Cada nível principal com n = 2 ou mais contém três orbitais p. As três orbitais p têm dois lóbulos com um nó localizado no núcleo. A orientação das orbitais p no espaço é descrita pelo valor de ml. As três orbitais p são mutuamente perpendiculares (ortogonais) entre si. As orbitais p superiores (3p, 4p, 5p, e superiores) têm formas semelhantes, mas são maiores em tamanho com nós radiais adicionais.
Níveis principais com n = 3 ou mais contêm cinco orbitais d. Quatro dessas orbitais consistem em uma forma de folha de trevo, com quatro lóbulos densos em eletrões. Existem dois planos de nós perpendiculares que se cruzam no núcleo. Nesses planos de nós, a densidade de eletrões é zero. Uma das orbitais d é ligeiramente diferente na forma e tem dois lóbulos orientados no eixo z com um anel em forma de donut no plano xy. Níveis principais com n = 4 e superior contêm sete orbitais f, que têm formas complexas. Estas orbitais têm mais nós e lóbulos do que as orbitais d.
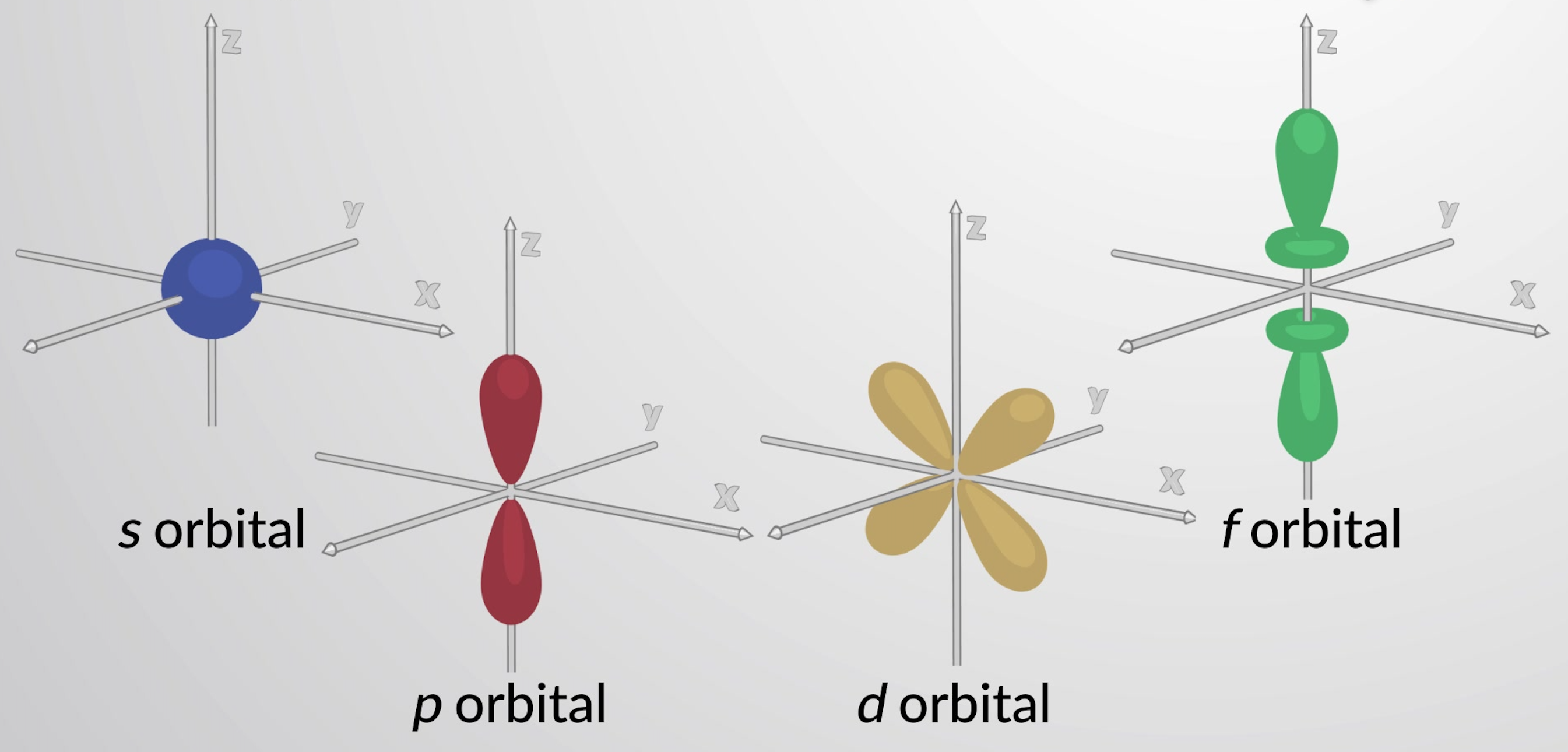
Figura 1: Orbitais s, p, d e f representativas.
Estas diferentes formas das orbitais atómicas representam as regiões tridimensionais dentro das quais é provável que o eletrão seja encontrado. Todas as orbitais juntas formam uma forma aproximadamente esférica, e é por isso que os átomos são geralmente representados como esferas.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
