7.9:
O Modelo Mecânico-Quântico de um Átomo
37,046 Views
•
•
Pouco depois de de Broglie ter publicado as suas ideias de que o eletrão em um átomo de hidrogénio poderia ser melhor pensado como sendo uma onda circular estacionária em vez de uma partícula que se move em órbitas circulares quantizadas, Erwin Schrödinger estendeu o trabalho de de Broglie ao derivar o que é agora conhecido como a equação de Schrödinger. Quando Schrödinger aplicou a sua equação a átomos hidrogenóides, ele foi capaz de reproduzir a expressão de Bohr para a energia e, assim, a fórmula de Rydberg que rege os espectros do hidrogénio. Schrödinger descreveu os eletrões como ondas estacionárias tridimensionais, ou funções de onda, representadas pela letra Grega psi, ψ.
Alguns anos depois, Max Born propôs uma interpretação da função de onda ψ que ainda é aceite hoje: Os eletrões são partículas estacionárias, pelo que as ondas representadas por ψ não são ondas físicas mas, em vez disso, são amplitudes de probabilidade complexas. O quadrado da magnitude de uma função de onda ∣ψ∣2 descreve a probabilidade de a partícula quântica estar presente perto de uma determinada localização no espaço. Isto significa que as funções de onda podem ser utilizadas para determinar a distribuição da densidade dos eletrões em relação ao núcleo em um átomo. Na forma mais geral, a equação de Schrödinger pode ser escrita como:
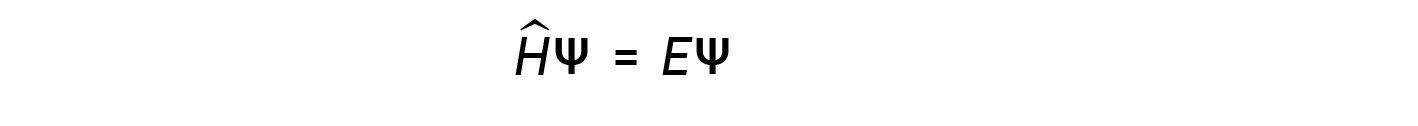
onde, Ĥ é o operador Hamiltoniano, um conjunto de operações matemáticas que representam a energia total (potencial mais cinética) da partícula quântica (como um eletrão em um átomo), ψ é a função de onda desta partícula que pode ser usada para encontrar a distribuição especial da probabilidade de encontrar a partícula, e E é o valor real da energia total da partícula.
O trabalho de Schrödinger, bem como o de Heisenberg e de muitos outros cientistas que seguiram os seus passos, é geralmente referido como mecânica quântica.
O modelo mecânico-quântico descreve uma orbital como um espaço tridimensional em torno do núcleo dentro de um átomo, onde a probabilidade de encontrar um eletrão é a mais alta.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
