5.10:
Gases reales - Desviación de la Ley de los Gases Ideales
31,710 Views
•
•
Hasta ahora, la ley de los gases ideales, PV = nRT, se ha aplicado a una variedad de problemas de diferentes tipos, que van desde la estequiometría de una reacción y problemas de fórmula empírica y molecular hasta la determinación de la densidad y masa molar de un gas. Sin embargo, el comportamiento de un gas a menudo no es ideal, lo que significa que las relaciones observadas entre su presión, volumen y temperatura no están descritas con precisión por las leyes de los gases.
Según la teoría cinético molecular, las partículas de un gas ideal no exhiben fuerzas de atracción o repulsión unas sobre las otras. Se supone que tienen un volumen insignificante en comparación con el del contenedor. A temperatura ambiente y a 1 atm o menos, los gases siguen el comportamiento ideal, como está implícito en la ecuación de los gases ideales.
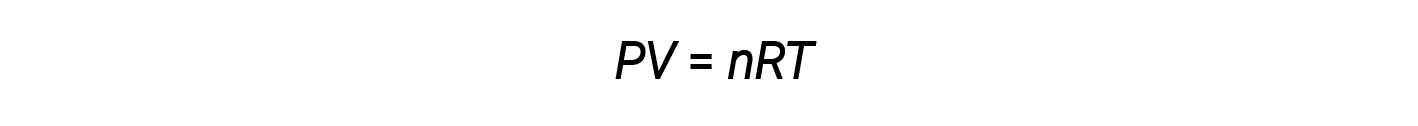
Sin embargo, a presiones más altas o temperaturas más bajas, se producen desviaciones de la ley de los gases ideales, lo que significa que las relaciones observadas entre su presión, volumen y temperatura no se siguen con precisión.
La reorganización de la ecuación de los gases ideales para resolver n da:
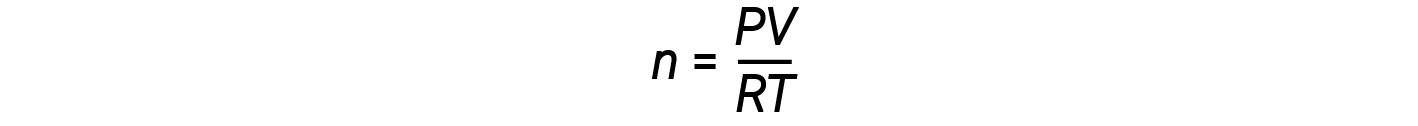
Para 1 mol de un gas ideal, la relación PV/RT = 1, independientemente de la presión. Cualquier desviación de esta relación de uno es una indicación de comportamiento no ideal.
La ley de los gases ideales no describe bien el comportamiento de los gases a presiones relativamente altas. Es decir, la relación es igual a 1 sólo a bajas presiones. Pero a medida que aumenta la presión, la PV/RT comienza a desviarse de 1 y las desviaciones no son uniformes. A altas presiones, la desviación del comportamiento ideal es grande y diferente para cada gas. Los gases reales, en otras palabras, no se comportan idealmente a alta presión. Sin embargo, a presiones más bajas (generalmente por debajo de 10 atm), la desviación del comportamiento ideal es pequeña y podemos usar la ecuación de los gases ideales.
Las partículas de un gas ideal hipotético no tienen un volumen significativo y no se atraen ni se repelen entre sí. En general, los gases reales se aproximan a este comportamiento a presiones y temperaturas relativamente bajas. Sin embargo, a altas presiones, las moléculas de un gas están más juntas y la cantidad de espacio vacío entre las moléculas se reduce. A presiones más altas, el volumen de las moléculas de gas se vuelve apreciable en relación con el volumen total ocupado por el gas. El gas, por lo tanto, se hace menos compresible ante estas altas presiones, y aunque su volumen continúa disminuyendo con el aumento de la presión, esta disminución no es proporcional como predijo la ley de Boyle.
A presiones relativamente bajas, las moléculas de gas prácticamente no tienen atracción entre sí porque están (en promedio) muy distanciadas y se comportan casi como partículas de un gas ideal. Sin embargo, a presiones más altas, la fuerza de atracción ya no es insignificante. Esta fuerza acerca sutilmente las moléculas, disminuyendo ligeramente la presión (si el volumen es constante) o disminuyendo el volumen (a presión constante). Este cambio es más pronunciado a bajas temperaturas porque las moléculas tienen menor Ec en relación con las fuerzas de atracción, y por lo tanto son menos eficaces en superar estas atracciones después de chocar unas con otras.
Hay varias ecuaciones diferentes que se aproximan mejor al comportamiento de los gases que la ley de los gases ideales. El primero, y el más simple de ellos, fue desarrollado por el científico holandés Johannes van der Waals en 1879. La ecuación de van der Waals mejora la ley de los gases ideales añadiendo dos términos: Uno para explicar el volumen de las moléculas de gas y otro para las fuerzas de atracción entre ellas.
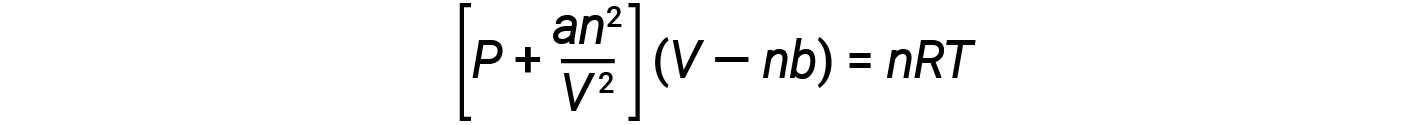
La constante a corresponde a la fuerza de atracción entre las moléculas de un gas particular, y la constante b corresponde al tamaño de las moléculas de un gas particular. La “corrección” al término de presión en la ley de los gases ideales es an2/V2, y la “corrección” al volumen es nb. Tenga en cuenta que cuando V es relativamente grande y n es relativamente pequeño, ambos términos de corrección se vuelven insignificantes, y la ecuación de van der Waals se reduce a la ley de los gases ideales, PV = nRT. Tal condición corresponde a un gas en el cual un número relativamente bajo de moléculas está ocupando un volumen relativamente grande, es decir, un gas a una presión relativamente baja.
A bajas presiones, la corrección de la atracción intermolecular, a, es más importante que la del volumen molecular, b. A altas presiones y pequeños volúmenes, la corrección del volumen de las moléculas se vuelve importante porque las moléculas mismas son incompresibles y constituyen una fracción apreciable del volumen total. A una cierta presión intermedia, las dos correcciones tienen influencias opuestas, y el gas parece seguir la relación dada por PV = nRT sobre un pequeño rango de presiones.
Estrictamente hablando, la ecuación de los gases ideales funciona bien cuando las atracciones intermoleculares entre moléculas de gas son insignificantes, y las moléculas de gas no ocupan una parte apreciable de todo el volumen. Estos criterios se cumplen en condiciones de baja presión y alta temperatura. En tales condiciones, se dice que el gas se comporta idealmente, y las desviaciones de las leyes de los gases son lo suficientemente pequeñas como para que puedan ser ignoradas; sin embargo, muy a menudo no es así.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 9.2: Comportamiento del Gas No Ideal.
