15 N CPMG Relaxation Dispersão para a Investigação da Dinâmica Conformacional de Proteínas na escala de tempo μs-ms
Summary
Aqui, é fornecida uma descrição detalhada do protocolo implementado no laboratório para aquisição e análise de perfis de dispersão de relaxamento de 15N por espectroscopia de solução NMR.
Abstract
A dinâmica conformacional proteica desempenha papéis fundamentais na regulação da catálise enzimática, ligação de ligantes, aosteria e sinalização, que são importantes processos biológicos. Entender como o equilíbrio entre estrutura e dinâmica rege a função biológica é uma nova fronteira na biologia estrutural moderna e tem inflamado diversos desenvolvimentos técnicos e metodológicos. Entre estes, os métodos NMR da solução de relaxamento cpmg fornecem informações únicas de resolução atômica sobre a estrutura, cinética e termodinâmica do equilíbrio conformacional proteico que ocorre na escala de tempo μs-ms. Aqui, o estudo apresenta protocolos detalhados para aquisição e análise de um experimento de dispersão de relaxamento de 15N. Como exemplo, o pipeline para a análise da dinâmica μs-ms no domínio terminal C da bactéria Enzima I é mostrado.
Introduction
Os experimentos de dispersão de relaxamento (RD) Carr-Purcell Meiboom-Gill (CPMG) são usados em uma base de rotina para caracterizar o equilíbrio conformacional que ocorre na escala de tempo μs-ms por solução espectroscopia NMR1,2,3,4,5. Em comparação com outros métodos de investigação da dinâmica conformacional, as técnicas de CPMG são relativamente fáceis de implementar em espectrômetros de RN modernos, não exigem etapas especializadas de preparação de amostras (ou seja, cristalização, congelamento ou alinhamento de amostras e/ou conjugação codinâmica com uma etiqueta fluorescente ou paramagnética), e fornecem uma caracterização abrangente do equilíbrio conformacional retornando informações estruturais, cinéticas e termodinâmicas em processos de troca. Para que um experimento cpmg informe sobre um equilíbrio conformacional, duas condições devem ser aplicadas: (i) as rodadas de RMN observadas devem possuir diferentes mudanças químicas nos estados submetidos à troca conformacional (microestados) e (ii) a troca deve ocorrer em uma escala de tempo que varia de ~50 μs a ~10 ms. Nessas condições, a taxa de relaxamento transversal observada 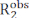 é a soma do R2 intrínseco (o R2 medido na ausência de dinâmica μs-ms)
é a soma do R2 intrínseco (o R2 medido na ausência de dinâmica μs-ms) 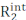 e a contribuição cambial para o relaxamento transversal (Rex). A contribuiçãoR ex para R2obs pode ser progressivamente saciada reduzindo o espaçamento entre os pulsos de 180° que constituem o bloco CPMG da sequência de pulso, e as curvas RD resultantes podem ser modeladas usando a teoria Bloch-McConnell para obter a diferença de mudança química entre os microestados, a população fracionária de cada microestado, e as taxas de troca entre microestados (Figura 1)1,2,3.
e a contribuição cambial para o relaxamento transversal (Rex). A contribuiçãoR ex para R2obs pode ser progressivamente saciada reduzindo o espaçamento entre os pulsos de 180° que constituem o bloco CPMG da sequência de pulso, e as curvas RD resultantes podem ser modeladas usando a teoria Bloch-McConnell para obter a diferença de mudança química entre os microestados, a população fracionária de cada microestado, e as taxas de troca entre microestados (Figura 1)1,2,3.
Várias sequências de pulso diferentes e protocolos de análise foram relatados na literatura para experimentos de 15N CPMG. Aqui, o protocolo implementado no laboratório é descrito. Em particular, serão introduzidas as etapas cruciais para a elaboração da amostra de RMN, a configuração e aquisição dos experimentos de RMN e o processamento e análise dos dados da RMN(Figura 2). Para facilitar a transferência do protocolo para outros laboratórios, o programa de pulso, scripts de processamento e análise e um exemplo de conjunto de dados são fornecidos como Arquivos Suplementares e estão disponíveis para download em (https://group.chem.iastate.edu/Venditti/downloads.html). A sequência de pulso fornecida incorpora um ciclo de fase de quatro etapas no bloco CPMG para supressão de artefatos dependentes de deslocamento6 e é codificada para aquisição de vários experimentos intercalados. Esses experimentos intercalados têm um período de relaxamento idêntico, mas números diferentes de pulsos de refoco, a fim de alcançar diferentes campos CPMG7. Também é importante notar que o programa de pulso descrito mede o 15N R2 do componente TROSY do sinal NMR8. No geral, o protocolo foi aplicado com sucesso para a caracterização da troca conformacional em proteínas de médio e grande porte4,5,9,10. Para sistemas menores (<20 kDa), o uso de uma sequência de pulso baseada em Coerência Quântica Única Heteronuclear (HSQC)é aconselhável.
Protocol
Representative Results
Discussion
Este manuscrito descreve o protocolo implementado em laboratório para aquisição e análise de dados de 15N RD sobre proteínas. Em particular, são abordadas as etapas cruciais para a preparação da amostra de RMN, medição dos dados de RMN e análise dos perfis rd. Abaixo alguns aspectos importantes sobre a aquisição e análise de experimentos de RD são discutidos. No entanto, para uma descrição mais aprofundada do experimento e análise de dados, o estudo cuidadoso da literatura original é altamen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado por fundos da NIGMS R35GM133488 e do Roy J. Carver Charitable Trust para V.V.
Materials
| Cryoprobe | Bruker | 5mm TCI 800 H-C/N-D cryoprobe | Improve sensitivity |
| Deuterium Oxide | Sigma Aldrich | 756822-1 | >99.8% pure, utilised in preparing NMR samples and deuterated cultures |
| Hand driven centrifuge | United Scientific supply | CENTFG1 | Used to remove any air bubbles or residual liquid stuck on the walls of NMR tube. |
| High Field NMR spectrometer | Bruker | Bruker Avance II 600, Bruker Avance 800 | acquisition of the NMR data |
| MATLAB | MathWorks | https://www.mathworks.com/products/get-matlab.html | Modeling of the NMR data |
| NMR pasteur Pipette | Corning Incorporation | 7095D-NMR | Pyrex glass pastuer pipette to transfer liquid sample in NMR tube |
| NMR tube | Willmad Precision | 535-PP-7 | 5mm thin wall 7'' cylinderical glass tube |
| NMRPipe | Institute of Biosciences and Biotechnology research | https://www.ibbr.umd.edu/nmrpipe/install.html | NMR data processing |
| SPARKY | University of California, San Francisco | https://www.cgl.ucsf.edu/home/sparky/ | Analysis of the NMR data |
| Tospin 3.2 (or newer) | Bruker | https://www.bruker.com/protected/en/services/software-downloads/nmr/pc/pc-topspin.html | acquisition software |
References
- Anthis, N. J., Clore, G. M. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48 (1), 35-116 (2015).
- Lisi, G. P., Loria, J. P. Solution NMR spectroscopy for the study of enzyme allostery. Chemical Reviews. 116 (11), 6323-6369 (2016).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Venditti, V., Clore, G. M. Conformational selection and substrate binding regulate the monomer/dimer equilibrium of the C-terminal domain of Escherichia coli enzyme I. Journal of Biological Chemistry. 287 (32), 26989-26998 (2012).
- Venditti, V., et al. Large interdomain rearrangement triggered by suppression of micro- to millisecond dynamics in bacterial Enzyme I. Nature Communications. 6, 5960 (2015).
- Yip, G. N., Zuiderweg, E. R. A phase cycle scheme that significantly suppresses offset-dependent artifacts in the R2-CPMG 15N relaxation experiment. Journal of Magnetic Resonance. 171 (1), 25-36 (2004).
- Mulder, F. A., Skrynnikov, N. R., Hon, B., Dahlquist, F. W., Kay, L. E. Measurement of slow (micros-ms) time scale dynamics in protein side chains by (15)N relaxation dispersion NMR spectroscopy: application to Asn and Gln residues in a cavity mutant of T4 lysozyme. Journal of the American Chemical Society. 123 (5), 967-975 (2001).
- Loria, J. P., Rance, M., Palmer, A. G. A TROSY CPMG sequence for characterizing chemical exchange in large proteins. Journal of Biomolecular NMR. 15 (2), 151-155 (1999).
- Dotas, R. R., et al. Hybrid thermophilic/mesophilic enzymes reveal a role for conformational disorder in regulation of bacterial Enzyme I. Journal of Molecular Biology. 432 (16), 4481-4498 (2020).
- Purslow, J. A., et al. Active site breathing of human Alkbh5 revealed by solution NMR and accelerated molecular dynamics. Biophysical Journal. 115, 1895-1905 (2018).
- Loria, J. P., Rance, M., Palmer, A. G. A relaxation-compensated Carr−Purcell−Meiboom−Gill sequence for characterizing chemical exchange by NMR Spectroscopy. Journal of the American Chemical Society. 121 (10), 2331-2332 (1999).
- Hansen, D. F., Vallurupalli, P., Kay, L. E. An improved 15N relaxation dispersion experiment for the measurement of millisecond time-scale dynamics in proteins. Journal of Physical Chemistry B. 112 (19), 5898-5904 (2008).
- Tugarinov, V., Kanelis, V., Kay, L. E. Isotope labeling strategies for the study of high-molecular-weight proteins by solution NMR spectroscopy. Nature Protocols. 1 (2), 749-754 (2006).
- Niklasson, M., et al. Comprehensive analysis of NMR data using advanced line shape fitting. Journal of Biomolecular NMR. 69, 93-99 (2017).
- Palmer, A. G., Kroenke, C. D., Loria, J. P. Nuclear magnetic resonance methods for quantifying microsecond-to-millisecond motions in biological macromolecules. Methods in Enzymology. 339, 204-238 (2001).
- Tollinger, M., Skrynnikov, N. R., Mulder, F. A., Forman-Kay, J. D., Kay, L. E. Slow dynamics in folded and unfolded states of an SH3 domain. Journal of the American Chemical Society. 123, 11341-11352 (2001).
- Carver, J. P., Richards, R. E. A general two-site solution for the chemical exchange produced dependence of T2 upon the Carr-Purcell pulse separation. Journal of Magnetic Resonance. 6 (1), 89-105 (1972).
- Egner, T. K., et al. Surface Contrast’ NMR Reveals Non-innocent Role of Support in Pd/CeO2 Catalyzed Phenol Hydrogenation. ChemCatChem. 12 (6), 4160-4166 (2020).
- Egner, T. K., Naik, P., Nelson, N. C., Slowing, I. I., Venditti, V. Mechanistic Insight into Nanoparticle Surface Adsorption by Solution NMR Spectroscopy in an Aqueous Gel. Angewandte Chemie (International Edition in English). 56, 9802-9806 (2017).
- Tugarinov, V., Libich, D. S., Meyer, V., Roche, J., Clore, G. M. The energetics of a three-state protein folding system probed by high-pressure relaxation dispersion NMR spectroscopy. Angewandte Chemie (International Edition in English). 54, 11157-11161 (2015).
- Korzhnev, D. M., Kloiber, K., Kanelis, V., Tugarinov, V., Kay, L. E. Probing slow dynamics in high molecular weight proteins by methyl-TROSY NMR spectroscopy: application to a 723-residue enzyme. Journal of the American Chemical Society. 126 (12), 3964-3973 (2004).
- Mayzel, M., Ahlner, A., Lundstrom, P., Orekhov, V. Y. Measurement of protein backbone (13)CO and (15)N relaxation dispersion at high resolution. Journal of Biomolecular NMR. 69, 1-12 (2017).
- Pritchard, R. B., Hansen, D. F. Characterising side chains in large proteins by protonless (13)C-detected NMR spectroscopy. Nature Communications. 10, 1747 (2019).

