Как для стабилизации белка: стабильность экраны для тепловых сдвиг анализов и Nano дифференциальная сканирующая флуориметрия в проекте вирус X
Summary
Протокол, как представляется, быстро проверить термическая стабильность белков в различных условиях через тепловые сдвиг анализов и nano дифференциальной сканирование флуориметрия. Буферные системы, солей и добавки, вместе состоит из трех уникальных стабильности экранов, являются assayed с белками для выявления подходящих буферы для функциональных и структурных исследований.
Abstract
Horizon2020 вирус-X проект был создан в 2015 году, чтобы исследовать virosphere отдельных крайних биотопов и открывать новые вирусные белки. Чтобы оценить потенциальные биотехнические значение этих белков, анализ белков структур и функций является главной проблемой в этой программе. Стабильность образца белка имеет важное значение для обеспечения значимого анализа результатов и увеличить crystallizability целей. Assay тепловой сдвига (TSA), на основе флуоресценции технику, устанавливается как популярный метод для оптимизации условий для стабильности белка в высокой пропускной способности. В ВСТ занятых флуорофоров, внешняя, экологически чувствительных красители. Альтернативой, подобный метод является nano дифференциальной сканирование флуориметрия (nanoDSF), которая опирается на родной флуоресценции белков. Мы представляем здесь Роман osmolyte экран, 96-условие органических добавок, предназначенных для руководства кристаллизации испытания через предварительные эксперименты TSA. Вместе с ранее разработанных рН и соли экраны набор трех экранов обеспечивает всесторонний анализ белков стабильность в широком диапазоне буферной системы и добавок. Полезность экраны проявляется в ВСТ и nanoDSF анализ лизоцима и белок X, целевого белка вируса-X проекта.
Introduction
Многие биотехнологическим полезные ферменты происходят из вирусного источников, таких как табак etch протеазы вируса (TEV)1 и 3 C (HRV 3 C) протеазы2типа человека риновирус. Horizon2020 вирус-X проекта (рис. 1)3. Цель этой программы — (), чтобы расширить спектр свойств семей известных ферментов и (b) для характеристики новых ферментов еще неизвестной функции (фермент X). Определение Кристаллографическая структура играет ключевую роль в характеристике целевых белков, в частности в тех случаях, когда белковых последовательностей эволюционировали за признание4. Стабильность белков является ключевым фактором в процессе кристаллизации; образцы должны быть конформационно однородных и структурно звука в течение времени в форме высокого качества, Дифрагирующая кристаллов. Кроме того крайне важно для анализов деятельности существуют белки в их активной конформации, который также может быть облегчено благоприятной молекулярной среды.
Несмотря на развитие технологий, доступных для Кристаллографов кристаллизации белка остается длительным и трудоемким эмпирический процесс5. Предварительные биофизические эксперименты для повышения стабильности белка в растворе четко дать лучшей отправной точкой для кристаллизации белка и обычно потребляют лишь сравнительно небольшое количество белка образец6,7, 8,9. Большое количество целевых белков необходимо изучить в рамках этого проекта также требует масштабируемые, высок объём стабильности анализов. Один из самых популярных методов для предварительной кристаллизации биофизические характеристики белков является термальный переход пробирного (также известный как TSA или дифференциальная сканирующая флуориметрия, DSF)10,11.
ВСТ используют Люминесцентную краску экологически чувствительных для отслеживания тепловой денатурации белков образцов. Многие часто используемые красители имеют переменной флуоресценции активность в зависимости от полярности их окружающей среды, часто вывода высокий флуоресценции в гидрофобных средах, но подвергается быстрой закалки в полярных средах12. Белки обычно вызывает выраженный рост в Люминесцентная краска, как их гидрофобные ядер подвергаются во время денатурации, часто сопровождается снижением Люминесцентная краска при очень высоких температурах, как белки начинают агрегат (рис. 2).
Хотя гидрофобность чувствительных красителем часто является хорошим выбором для общего использования TSA краска, это может быть непригодной для белков с большой, воздействию растворителей гидрофобные регионами, которые часто отображения пагубно высокий фон флуоресценции. Флуорофоров с альтернативных видов действий существуют (см. обсуждение), но вместо этого может быть желательно отслеживать денатурации через встроенные белка флюоресценции с nanoDSF.
Триптофан остатков, которые похоронены в неполярных регионах белка флуоресцировать выбросов более 330 Нм. Как образец протеина разворачивается, и эти остатки подвергаются Полярный растворитель, их выбросов максимальная проходит bathochromic переход к 350 Нм13. nanoDSF использует этот сдвиг в выбросов максимальная зонда разворачивается образец протеина без необходимости внешние флуорофоров14.
Расплава кривых, которые показаны один денатурации шаги могут быть проанализированы на установку данных в модель сигмоид Больцмана. Температура в точке перегиба разворачивающихся перехода (mT) используется как количественная мера белка термостабильности и эталоном для сравнения favorability различных условий.
Кривые расплава же белка в различных условиях иногда обладают степенью неоднородности, которые могут сделать Больцмана сигмоид штуцер неосуществимым. Различать значенияm T из данных, отличается от классической кривой топологии, численные методы могут использоваться такие как занятые в NAMI, открытым исходным кодом TSA данных анализа программы11. Альтернативные термодинамические основы может также использоваться для анализа более сложных кривых с несколькими денатурации шаги, например методологии ProteoPlex15.
Стабильность экраны были разработаны для использования в TSA и nanoDSF эксперименты быстро определить благоприятные условия для целевого белка (рис. 3, экран композиций доступны в дополнительной информации). Информация, собранная с экранов может использоваться на многих стадиях кристаллографических трубопровода, в том числе: образец хранения; очищение, минимизации потерь урожайности через белка, разворачивается во время процесса очистки; пробирного дизайн, армирующие белка функциональность в деятельности анализов с термически стабилизации буферов и, наконец, кристаллизации, направляя рационально разработан кристаллизации испытания.
Выбор подходящего буферной системы основы для Образец протеина имеет жизненно важное значение; несовместимые рН может привести к деактивации или денатурации белка. Однако наличие совместно кристаллизуется буфера молекул, решен в большое количество рентгеновских кристалл структур (Таблица 1) может также свидетельствовать о стабилизирующее воздействие, что отдельный для регулирования простой рН и вместо этого проистекает из химической особенности молекулы буфера.
Сформулированы, используя несколько хорошо в буферы17,18,19 наряду с другими буфера обычно биологически совместимых систем, рН экран предназначен для deconvolute химический эффект молекула буфера на стабильность белков от фактической pH полученного раствора. Предоставляя три значения рН для каждой буферной системы и включения избыточности значение рН между различными системами, рН экрана можно определить благоприятные рН и благоприятные буферные системы для целевого белка.
Соли экран содержит обычно Лаборатория солей, а также chaotropes, chelants, тяжелых металлов и восстановителей. Экран может дать общее представление о схожести образец протеина в средах с высокой ионной силы, но каждая подгруппа соединений может также предоставить информацию о потенциальных структуры белка. Например Челант, существенно дестабилизирует белок может свидетельствовать о важных структурных металлов в образце. Если образец стабилизируется также сильно катиона металла в пределах экрана, это может обеспечить перспективные отправной точкой для дальнейших структурных экспериментов.
Osmolytes являются растворимые соединения, которые влияют на осмотические свойства окружающей их среды. В природе они могут использоваться как «химическая сопровождающих», складывающиеся неупорядоченных белков и стабилизации их, особенно в стресс условий20,21,22. Эти характеристики делают их привлекательными добавок белка Кристаллография; 23процессов может использоваться как криопротекторы во время сбора урожая кристалл, монтажа и хранения. Osmolytes потенциального использования распространяется также на очистки белков. Значительную долю в E. coli рекомбинантных белков может быть нерастворимы и трудно восстановить в родной штат с использованием методов стандартной очистки. Osmolytes могут быть использованы для стабилизации и спасти белки из нерастворимых фракций, очистки увеличения урожайности24.
Osmolyte экран был разработан с использованием установленных соединений, присутствующих в банк данных белков записи25 и база данных26 Dragon Explorer of Osmoprotection-Associated пути (DEOP) и многократно оптимизированы с помощью стандартных белков. Экран построен около восьми подклассы osmolyte: глицерин, сахаров и полиолов, без моющих средств sulfobetaines (NDSBs), бетаины и их аналоги, органофосфатов, дипептиды, аминокислоты и их производные и окончательное разные группы. Каждый osmolyte присутствует в нескольких концентрации, основанный на его растворимость и эффективная концентрация диапазоны для сравнения.
Protocol
Representative Results
Discussion
Важные аспекты в рамках Протокола включают шаг центрифугирования и надлежащей герметизации 96-луночных пластины для ВСТ экспериментов (шаг 1.5). Центрифугирование гарантирует, что белок образца и экран состояния вступают в контакт и перемешать. Кроме того если используется незапечатанных пластина для эксперимента TSA, существует значительный риск растворитель испаряется на протяжении эксперимента, вызывая увеличение концентрации образца и увеличивая вероятность недоношенных белок агрегации.
ВСТ и nanoDSF поддаются широкий спектр образцов белка; Подавляющее большинство образцов может производить интерпретируемых расплава кривых с краской на основе гидрофобность репортер или через nanoDSF краска бесплатно. Если стандартные флуоресценции источники не подходят для вашего протеина, простой модификации протокола, можно было бы изучить это выбор Флюорофор. Несколько альтернативных красители могут быть пригодны для ВСТ экспериментов. Примеры включают N-[4-(7-diethylamino-4-methyl-3-coumarinyl)phenyl]maleimide (CPM), смесь, которая флуоресцирует после реагируя с тиоловых27и 4 – julolidine (dicyanovinyl) (DCVJ), соединение, которое меняется его флуоресценции, основанный на жесткость ее окружающей среды, увеличивая его флуоресценции как образец протеина разворачивается28,29 (последний красителем часто требует высокой концентрации образца).
Альтернативные методы анализа кривой расплава доступны, если Tm не рассчитывается автоматически инструмент программного обеспечения. Если данные однородных и только одного шага denaturation проявляется в кривых расплава, усеченные набора данных могут быть установлены в сигмовидной кишки с помощью следующего уравнения Больцмана:
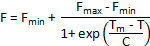
Где F — это интенсивность флуоресценции при температуре T, Fмин и FМакс интенсивностью флюоресценции до и после перехода денатурации, соответственно, Tm середина Температура денатурации перехода и C — это наклон Tm. Хотя этот метод хорошо работает для простой двухэтапный денатурации процессов, она непригодна для сложных расплава кривых с нескольких переходов.
Одним из основных преимуществ TSA является его доступность; TSA эксперименты могут выполняться в любой системе, RT-PCR с фильтрами на длинах волн подходит для флуоресценции краска работу. Это в сочетании с низкой стоимостью расходных материалов, простота эксплуатации и относительно малое количество белков, необходимых, чтобы TSA полезен для широкого круга масштабов проекта, как в промышленности и научных кругов.
А также указывая условия благоприятные буфера, экраны содержат некоторые скважины, которые может дать ключи к присутствие конструкционных металлов в образец протеина. Скважины, которые могут представлять особый интерес в экране соли являются G6 и G7, содержащие ЭДТА 5 мм и 5 мм EGTA, соответственно. Значительный тепловой дестабилизации в этих скважинах может свидетельствовать о важных ионов металлов в протеине, которые изолированы от chelants. Соединений на osmolyte экране также потенциально обеспечивающие функции белка. Многие из этих соединений на экране принадлежат классы молекулы, которые являются общей субстраты ферментов. Например к их структурным сходством с установленным субстратов фермента, N-acetylglucosamine олигомеров30может объясняться общей стабилизации, обеспечиваемой углеводов (присутствует в скважинах A11-B10) для лизоцима.
ВСТ и nanoDSF протоколы, описанные выше также могут быть адаптированы для изучения взаимодействий протеин лиганд. Лиганды, которые конкретно связать белок может увеличить его термической стабильности путем введения новых взаимодействий внутри комплекса. Дозозависимый позитивный сдвиг в белок Tm является многообещающим признаком успешного белка лиганд взаимодействия. Скорость, пропускную способность и низкую стоимость скрининга составные библиотек с ВСТ сделал это очень популярный метод в ранней стадии лекарств.
Оптимизации условий буфера целевых белков и их комплексов лиганд может быть существенно важное значение для успеха проекта, как много литературы примерах31,,3233,34. С типичной assay, принимая младше 2 h, включая время настройки ВСТ и nanoDSF, в сочетании с экранов стабильности представляют собой быстрый и недорогой метод для оптимизации буфера.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Этот проект получил финансирование от Европейского Совета исследований (ERC) под исследовательской и инновационной программы Европейского союза по Horizon 2020 (Грант соглашение n ° 685778). Эта работа была поддержана биотехнологии и биологических наук научно-исследовательский совет (СИББН, Грант числа BB/M011186/1, BB/J014516/1). DB благодаря СИББН докторской обучения партнерства Ньюкасл-Ливерпуль-Дарем для студенчества и Даремского университета Департамента Biosciences за вклад в финансирование этой работы. Мы благодарим Даремского университета Департамента химии масс-спектрометрии для их инструментального анализа Департамента белок X и Иэн Эдвардс за его помощь. Мы благодарны Арнтор Ævarsson за его работу с проектом вирус-X и спасибо также NanoTemper GmbH и Клер Hatty кредитования и оказания помощи с системой Прометей NT.48 для этого проекта. Наконец спасибо Фрэнсис Gawthrop и Тозер семена за их поддержку в рамках СИББН iCASE премии.
Materials
| Lysozyme | Melford Laboratories | L38100 | Crystallised and lyophilised chicken egg white lysozyme. |
| The Durham pH Screen | Molecular Dimensions | MD1-101 | 96-well protein stability screen. See above for contents. |
| The Durham Salt Screen | Molecular Dimensions | MD1-102 | 96-well protein stability screen. See above for contents. |
| The Durham Osmolyte Screen | Various | #N/A | 96-well protein stability screen, not commercially available at the time of publication. See above for contents. |
| SYPRO Orange | Invitrogen | S6651 | Widely used fluorescent dye for protein staining in gels and DSF. |
| 96-well PCR Plate | Starlab | 1403-7700 | Semi-skirted clear plastic for use with AB 7500 Fast RT-PCR System. |
| 7500 Fast Real-time PCR System | Applied Biosystems | 4362143 | 96-well format RT-PCR system. Alternative systems can be used. Analysis of data performed using free, open-access software NAMI. AB software tailored to DSF experiments using the 7500 Fast available at additional cost. |
| Prometheus NT.48 | NanoTemper Technologies | #N/A | Label-free DSF system with up to 48-sample capacity. Can calculate unfolding temperatures (Tm and Tonset), critical denaturant concentrations (Cm), free folding energy (ΔG and ΔΔG), and aggregation results (Tagg) using built-in software. |
| Prometheus NT.48 Series nanoDSF Grade Standard Capillaries | NanoTemper Technologies | PR-C002 | Prometheus NT.48 Series nanoDSF Grade Standard Capillaries. "High sensitivity" variants are available at a higher cost for use with low-concentration samples (<200 µg ml-1). |
References
- Kapust, R. B., Waugh, D. S. Controlled intracellular processing of fusion proteins by TEV protease. Protein Expression and Purification. 19 (2), 312-318 (2000).
- Cordingley, M. G., Register, R. B., Callahan, P. L., Garsky, V. M., Colonno, R. J. Cleavage of small peptides in vitro by human rhinovirus 14 3C protease expressed in Escherichia coli. Journal of Virology. 63 (12), 5037-5045 (1989).
- Hjorleifsdottir, S., Aevarsson, A., Hreggvidsson, G. O., Fridjonsson, O. H., Kristjansson, J. K. Isolation, growth and genome of the Rhodothermus RM378 thermophilic bacteriophage. Extremophiles. 18 (2), 261-270 (2014).
- Alva, V., Nam, S. Z., Söding, J., Lupas, A. N. The MPI bioinformatics Toolkit as an integrative platform for advanced protein sequence and structure analysis. Nucleic Acids Research. 44, 410-415 (2016).
- McPherson, A. Protein Crystallization. Methods in molecular biology. 1607, 17-50 (2017).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Reinhard, L., Mayerhofer, H., Geerlof, A., Mueller-Dieckmann, J., Weiss, M. S. IUCr Optimization of protein buffer cocktails using Thermofluor. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 69 (2), 209-214 (2013).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Kozak, S., Lercher, L., Karanth, M. N., Meijers, R., Carlomagno, T., Boivin, S. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular NMR. 64 (4), 281-289 (2016).
- Semisotnov, G. V., Rodionova, N. A., Razgulyaev, O. I., Uversky, V. N., Gripas’, A. F., Gilmanshin, R. I. Study of the “molten globule” intermediate state in protein folding by a hydrophobic fluorescent probe. Biopolymers. 31 (1), 119-128 (1991).
- Grøftehauge, M. K., Hajizadeh, N. R., Swann, M. J., Pohl, E. Protein-ligand interactions investigated by thermal shift assays (TSA) and dual polarization interferometry (DPI). Acta Crystallographica Section D: Biological Crystallography. 71, 36-44 (2015).
- Steinberg, T. H., Jones, L. J., Haugland, R. P., Singer, V. L. SYPRO Orange and SYPRO Red Protein Gel Stains: One-Step Fluorescent Staining of Denaturing Gels for Detection of Nanogram Levels of Protein. Analytical biochemistry. 239, 223-237 (1996).
- Burstein, E. A., Vedenkina, N. S., Ivkova, M. N. Fluorescence and the location of tryptophan residues in protein molecules. Photochemistry and Photobiology. 18 (4), 263-279 (1973).
- Haffke, M., Rummel, G., Boivineau, J., Münch, A., Jaakola, V. -. P. nanoDSF: label-free thermal unfolding assay of G-protein-coupled receptors for compound screening and buffer composition optimization. Application Note NT-PR-008. , (2016).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparsematrix screening of chemical space. Nature Methods. 12 (9), 859-865 (2015).
- Laskowski, R. A. PDBsum: summaries and analyses of PDB structures. Nucleic Acids Research. 29 (1), 221-222 (2001).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical biochemistry. 104 (2), 300-310 (1980).
- Welch, W. J., Brown, C. R. Influence of molecular and chemical chaperones on protein folding. Cell stress & chaperones. 1 (2), 109-115 (1996).
- Diamant, S., Eliahu, N., Rosenthal, D., Goloubinoff, P. Chemical chaperones regulate molecular chaperones in vitro and in cells under combined salt and heat stresses. The Journal of biological chemistry. 276 (43), 39586-39591 (2001).
- Yancey, P. H. Organic osmolytes as compatible, metabolic and counteracting cytoprotectants in high osmolarity and other stresses. Journal of Experimental Biology. 208 (15), 2819-2830 (2005).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 62 (1), 32-47 (2006).
- de Marco, A., Vigh, L., Diamant, S., Goloubinoff, P. Native folding of aggregation-prone recombinant proteins in Escherichia coli by osmolytes, plasmid- or benzyl alcohol- overexpressed molecular chaperones. Cell Stress & Chaperones. 10 (4), 329 (2005).
- Berman, H. M., et al. The protein data bank. Nucleic acids research. 28 (1), 235-242 (2000).
- Bougouffa, S., Radovanovic, A., Essack, M., Bajic, V. B. DEOP: A database on osmoprotectants and associated pathways. Database. 2014, 1-13 (2014).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Kung, C. E., Reed, J. K. Fluorescent molecular rotors: a new class of probes for tubulin structure and assembly. Biochemistry. 28 (16), 6678 (1989).
- Iio, T., Itakura, M., Takahashi, S., Sawada, S. 9-(Dicyanovinyl)julolidine binding to bovine brain calmodulin. Journal of biochemistry. 109 (4), 499-502 (1991).
- Veros, C. T., Oldham, N. J. Quantitative determination of lysozyme-ligand binding in the solution and gas phases by electrospray ionisation mass spectrometry. Rapid Communications in Mass Spectrometry. 21 (21), 3505-3510 (2007).
- Kean, J., Cleverley, R. M., O’Ryan, L., Ford, R. C., Prince, S. M., Derrick, J. P. Characterization of a CorA Mg2+ transport channel from Methanococcus jannaschii using a Thermofluor-based stability assay. Molecular membrane biology. 25 (8), 653-661 (2008).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallographica Section F. 68 (5), 596-600 (2012).
- Morgan, H. P., Zhong, W., McNae, I. W., Michels, P. A., Fothergill-Gilmore, L. A., Walkinshaw, M. D. Structures of pyruvate kinases display evolutionarily divergent allosteric strategies. Royal Society open science. 1 (140120), (2014).
- Moretti, A., Li, J., Donini, S., Sobol, R. W., Rizzi, M., Garavaglia, S. Crystal structure of human aldehyde dehydrogenase 1A3 complexed with NAD+ and retinoic acid. Scientific reports. 6 (35710), (2016).

