Hoe te stabiliseren van eiwit: stabiliteit schermen voor thermische verschuiven Assays en Nano Differential Scanning fluorimetrie in het Virus-X-Project
Summary
Een protocol is bedoeld om te snel testen van de thermische stabiliteit van eiwitten in een verscheidenheid van voorwaarden door middel van thermische shift testen en nano differentiële scanning van fluorimetrie. Buffer systemen, zouten en additieven, samen zijn bestaande uit drie unieke stabiliteit schermen, vehiculumcontrolegroep met eiwitten om te identificeren van geschikte buffers voor functionele en structurele studies.
Abstract
Het Horizon2020 Virus-X-project werd opgericht in 2015 aan de virosphere van geselecteerde extreme biotopen verkennen en ontdekken van nieuwe virale eiwitten. Ter evaluatie van de potentiële biotechnische waarde van deze eiwitten, de analyse van eiwit is structuren en functies een centrale uitdaging in dit programma. De stabiliteit van eiwitSteekproef is essentieel om zinvolle assay resultaten opleveren en de crystallizability van de doelstellingen te verhogen. De thermische shift assay (TSA), een fluorescentie gebaseerde techniek, is opgericht als een populaire methode voor het optimaliseren van de voorwaarden voor eiwitstabiliteit in high-throughput. In TSAs zijn de werknemer fluorophores extrinsieke, ecologisch-gevoelige kleurstoffen. Een alternatief, soortgelijke techniek is nano differential scanning fluorimetrie (nanoDSF), die gebaseerd op eiwitten inheemse fluorescentie is. Wij presenteren hier een roman osmolyte-scherm, een scherm 96-conditie van biologische additieven die zijn ontworpen om te begeleiden kristallisatie proeven door voorbereidende experimenten van de TSA. Samen met eerder ontwikkelde pH en zout schermen bevat de reeks van drie schermen een uitgebreide analyse van eiwitstabiliteit in een breed scala van buffer systemen en additieven. Het nut van de schermen wordt geïllustreerd in de TSA en nanoDSF analyse van lysozym en eiwit X, een proteïne van de doelstelling van het Virus-X-project.
Introduction
Vele biotechnologically-nuttige enzymen zijn afkomstig uit de virale bronnen, zoals de tabak etch virus (TEV) protease1 en menselijke rhinovirus 3 C (HSV 3 C) protease2typt. De Horizon2020 Virus-X project (Figuur 1)3. Het doel van dit programma is (a) uit te breiden het bereik van de eigenschappen van bekende enzym gezinnen en (b) te karakteriseren nieuwe enzymen van nog onbekende functie (enzym X). Kristallografische structuurbepaling speelt een sleutelrol bij de karakterisering van het eiwit van de doelstelling, met name in die gevallen waar de proteïne sequenties geëvolueerd zijn dan erkenning4. Eiwitstabiliteit is een belangrijke factor in de kristallisatie proces; monsters moeten conformationally homogene en structureel gezond over een periode van tijd om te formulier kwalitatief hoogwaardige, buigingsinrichting kristallen. Bovendien is het essentieel voor de activiteit testen die de eiwitten bestaan in hun actieve bevleesdheid, die ook kan worden vergemakkelijkt door een gunstige moleculaire omgeving.
Ondanks de ontwikkeling van de technologie beschikbaar voor kristallografen blijft eiwit kristallisatie een tijdrovend en arbeidsintensief empirische proces5. Voorbereidende biofysische experimenten ter verbetering van de stabiliteit van de eiwitten in oplossing geeft duidelijk een beter uitgangspunt voor eiwit kristallisatie en consumeren gewoonlijk slechts een relatief kleine hoeveelheid eiwit monster6,7, 8,9. Het grote aantal doel eiwitten worden bestudeerd in dit project vergt ook schaalbare, high-throughput stabiliteit testen. Een van de meest populaire methoden voor pre kristallisatie biofysische karakterisering van de eiwitten is de bepaling van de thermische shift (ook bekend als TSA of differential scanning fluorimetrie, DSF)10,11.
TSAs dienst een ecologisch gevoelige fluorescente kleurstof voor het bijhouden van het thermische denaturatie van EiwitSteekproeven. Veel gebruikte kleurstoffen hebben variabele fluorescentie activiteit afhankelijk van de polariteit van hun omgeving, vaak een hoge fluorescentie uitvoer weergeven in hydrofobe omgevingen maar ondergaan snel blussen in polar omgevingen12. Uitgesproken verhogingen veroorzaken eiwitten in het algemeen in kleurstof fluorescentie zoals hun hydrofobe kernen worden blootgesteld tijdens denaturatie, vaak gevolgd door een afname van de kleurstof fluorescentie bij zeer hoge temperaturen zoals eiwitten te aggregaat (Figuur 2 beginnen).
Terwijl een hydrophobicity-gevoelige kleurstof vaak een goede keuze voor een algemeen-gebruik TSA kleurstof is, kan het ongeschikt voor eiwitten met grote, oplosmiddel-blootgesteld hydrofobe regio’s, die vaak weer leefbaarheid hoge achtergrond fluorescentie. Fluorophores met alternatieve vervoerswijzen actie bestaan (zie discussie), maar in plaats daarvan voor het bijhouden van denaturatie door intrinsieke eiwit fluorescentie met nanoDSF wenselijk kan zijn.
Tryptofaan residuen die zijn begraven in apolaire regio’s van een eiwit lichten met een maximum van de emissie van 330 nm. Als een eiwitsteekproef ontvouwt en deze residuen worden blootgesteld aan een polair oplosmiddel, ondergaat hun maximale emissie een verschuiving van de bathochromic tot en met 350 nm13. nanoDSF exploiteert deze verschuiving in emissie maximale sonde de ontplooiing van een eiwitsteekproef zonder de noodzaak van Extrinsieke fluorophores14.
Smelt curven weergegeven: één denaturatie stappen kunnen worden geanalyseerd door het aanbrengen van gegevens naar een sigmoïdale model van Boltzmann. De temperatuur op het omslagpunt van de openende overgang (Tm) wordt gebruikt als een kwantitatieve meting van de thermische eiwitstabiliteit en een benchmark te vergelijken de favorability van verschillende omstandigheden.
Smelt curven van hetzelfde eiwit in verschillende omstandigheden bezitten soms een zekere mate van heterogeniteit waardoor een sigmoïdale montage van Boltzmann onhaalbaar. Om te onderscheiden Tm waarden uit gegevens die van de klassieke kromme topologie afwijkt, kunnen numerieke methoden worden gebruikt zoals degenen die werkzaam zijn in NAMI, een open-source TSA data analyse programma11. Alternatieve thermodynamische kaders kunnen ook worden gebruikt voor het analyseren van meer complexe curven met meerdere denaturatie stappen, zoals de ProteoPlex methodologie15.
De stabiliteit schermen werden ontworpen voor gebruik in TSA en nanoDSF experimenten te snel identificeren gunstige voorwaarden voor een doel-eiwit (Figuur 3, scherm composities zijn beschikbaar in de aanvullende informatie). Informatie verzameld met de schermen kan worden gebruikt in vele stadia van de kristallografische pijpleiding met inbegrip: proeven van opslag; zuivering, minimaliseren van opbrengst verlies door eiwit ontvouwen tijdens het zuiveringsproces; assay ontwerp, versterking van de functionaliteit van de eiwitten in activiteit testen met thermisch stabiliseren van buffers, en ten slotte kristallisatie, begeleiden van rationeel-ontworpen kristallisatie proeven.
Kiezen van een geschikte buffer systeem basis voor een eiwitsteekproef is essentieel; incompatibele pH-waarden kunnen leiden tot de deactivering of denaturatie van een eiwit. De aanwezigheid van co gekristalliseerde buffer moleculen opgelost in een groot aantal X-ray kristalstructuren (tabel 1) zou echter ook tekenend voor een stabiliserende invloed die aparte aan eenvoudige pH verordening is en in plaats daarvan komt voort uit de chemische functies van het buffer-molecuul.
Geformuleerd met behulp van een aantal goede buffers17,18,19 naast andere algemeen biologisch-compatibele buffer systemen, is de pH-scherm ontworpen om de chemische werking van een buffer-molecuul deconvolute op eiwitstabiliteit van de werkelijke pH van de resulterende oplossing. Door drie pH-waarden te verstrekken voor elke buffersysteem en pH waarde redundantie tussen verschillende systemen te integreren, kan de pH-scherm identificeren zowel gunstige pH-waarden en gunstige buffer systemen voor een doel-eiwit.
Het zout scherm bevat gewoonlijk laboratorium zouten, alsmede chaotropes, chelants, zware metalen en reductiemiddelen. Het scherm kan geven een algemene indicatie van de affiniteit van een eiwitsteekproef aan de omgevingen met hoge Ionische sterkte, maar elke deelgroep van de verbindingen kan ook informatie verschaffen over de mogelijke structuur van een eiwit. Bijvoorbeeld, zou een sterk destabiliserende een eiwit chelant indicatief van belangrijke structurele metalen binnen het monster. Als het monster is ook sterk gestabiliseerd door een metalen catie binnen het scherm, kan dit een veelbelovend uitgangspunt bieden voor verdere structurele experimenten.
Osmolytes zijn oplosbare verbindingen die van invloed zijn op de osmotische eigenschappen van hun omgeving. In de natuur, kunnen ze worden gebruikt als “chemische chaperones”, handhaving van de vouwen van wanordelijke eiwitten en hen, vooral in stress voorwaarden20,21,22te stabiliseren. Deze kenmerken maken hen aantrekkelijk additieven in eiwit kristallografie; bruikbaar als cryoprotectant tijdens het oogsten van de crystal, montage en opslag verwerkt23. Osmolytes potentiële gebruik geldt ook voor de zuivering van eiwitten. Een aanzienlijk deel van recombinante eiwitten uitgedrukt in E. coli kunnen onoplosbare en moeilijk te herstellen in de oorspronkelijke staat met behulp van standaard zuivering methoden. Osmolytes kan worden gebruikt om te stabiliseren en te redden van de eiwitten uit onoplosbare breuken, toenemende zuivering levert24.
Het scherm van de osmolyte werd ontworpen met behulp van gevestigde verbindingen aanwezig in Protein Data Bank posten25 en de Dragon Explorer of Osmoprotection-Associated trajecten (DEOP)26 database en iteratief geoptimaliseerd door het gebruik van standaard eiwitten. Het scherm is gebouwd rond acht subklassen van osmolyte: glycerol, suikers, polyolen, niet-wasmiddel sulfobetaines (NDSBs), betaine en hun analogen, organofosfaten, dipeptides, aminozuren en hun derivaten en een laatste diverse groep. Elke osmolyte is aanwezig in meerdere concentraties, gebaseerd op de oplosbaarheid en effectieve concentratie bereiken voor vergelijking.
Protocol
Representative Results
Discussion
Kritieke aspecten binnen het protocol omvatten het centrifugeren stap en de goede afdichting van de 96-wells-plaat voor TSA experimenten (stap 1.5). Centrifugeren zorgt ervoor dat het eiwit monster en scherm voorwaarde in contact komen en meng. Bovendien, als een onverharde plaat wordt gebruikt voor een TSA-experiment, is er een aanzienlijk risico van oplosmiddelen verdampen gedurende het gehele experiment, veroorzaakt een toename in de concentratie van het monster en het vergroten van de kans op voortijdige eiwit aggregatie.
TSAs en nanoDSF zijn vatbaar voor een breed scala aan EiwitSteekproeven; de overgrote meerderheid van monsters kan produceren interpreteerbaar smelt curven met een verslaggever van de hydrophobicity gebaseerde kleurstof of via kleurstof-vrije nanoDSF. Als standaard fluorescentie bronnen niet geschikt voor uw proteïne zijn, is de eenvoudigste wijziging van het protocol dat kan worden onderzocht de keuze van fluorophore. Verschillende alternatieve kleurstoffen kunnen worden geschikt voor de experimenten van de TSA. Voorbeelden zijn N-[4-(7-diethylamino-4-methyl-3-coumarinyl)phenyl]maleimide (CPM), een stof die fluoresceert na reageren met een thiol27, en 4-(dicyanovinyl) julolidine (DCVJ), een stof die varieert van de fluorescentie op basis van de stijfheid van de omgeving, het verhogen van de fluorescentie zoals een eiwitsteekproef28,29 ontvouwt (de laatste kleurstof vereist vaak hoge concentraties van monster).
Alternatieve methoden van smelt kromme analyse zijn beschikbaar als Tm niet automatisch door de software instrument is berekend. Als gegevens homogeen en slechts één denaturatie stap herkenbaar in de bochten smelt is, kan een afgeknotte dataset een Boltzmann sigmoid met de volgende vergelijking worden gemonteerd:
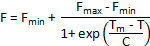
Waar F is de intensiteit van de fluorescentie bij temperatuur T, F,min enmax F zijn de intensiteit van de fluorescentie vóór en na de overgang denaturatie, respectievelijk, Tm is de temperatuur van de middelpunt van de denaturatie overgang en C is de helling op Tm. Hoewel deze methode goed voor eenvoudige tweestaps denaturatie processen werkt, is het niet geschikt is voor complexe smelt krommen met meerdere overgangen.
Een van de belangrijkste voordelen van TSA is zijn toegankelijkheid; TSA experimenten kunnen worden uitgevoerd in elk systeem RT-PCR met filters bij geschikte golflengten voor de kleurstof van de fluorescentie werkzaam. Dit in combinatie met de lage kosten van verbruiksartikelen, bedieningsgemak en relatief lage hoeveelheid eiwitten nodig, maken van TSA een waardevolle techniek voor een breed scala van project schalen, zowel in de industrie en de academische wereld.
Naast die gunstige buffer voorwaarden aangeeft, bevatten de schermen sommige putten die aanwijzingen aan de aanwezigheid van structurele metalen binnen een monster-eiwit kunnen geven. Putten die in het zout scherm van bijzonder belang worden kunnen zijn G6 en G7, die respectievelijk 5 mM EDTA en 5 mM EGTA, bevatten. Belangrijke thermische destabilisatie in deze putten kan worden indicatie van belangrijke metaalionen in het eiwit dat zijn afgezonderd door de chelants. Verbindingen binnen het scherm van de osmolyte kunnen mogelijk ook aanwijzingen voor de functie van een eiwit. Veel van de verbindingen in het scherm behoren tot klassen van molecule die gemeenschappelijk substraten van enzymen. Bijvoorbeeld, kan de algemene stabilisatie door sacchariden (aanwezig in putten A11-B10) voor lysozym geboden worden toegeschreven aan hun structurele gelijkenis met gevestigde substraten van het enzym, N-acetylglucosamine oligomeren30.
De protocollen van het TSA en nanoDSF hierboven beschreven kunnen ook worden aangepast aan de studie van eiwit-ligand interacties. Liganden die specifiek aan een proteïne binden kunnen verhogen de thermische stabiliteit door de invoering van nieuwe interacties binnen het complex. Een dosis-afhankelijke positieve verschuiving in eiwit Tm is een veelbelovende teken van een succesvolle eiwit-ligand interactie. De snelheid, de gegevensdoorvoer en de lage kosten van het screenen van samengestelde bibliotheken met TSAs heeft gemaakt een zeer populaire methode in vroeg stadium drugontdekking.
Optimaliseren van de voorwaarden van de buffer voor doel eiwitten en hun ligand complexen kan essentieel zijn voor een project van succes, zoals veel literatuur voorbeelden31,32,33,34 aantonen. Met een typische assay nemen onder 2 h, met inbegrip van de insteltijd, vormen TSAs en nanoDSF in combinatie met stabiliteit schermen een snelle en goedkope techniek voor buffer optimalisaties.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit project heeft ontvangen financiering van de Europese Onderzoeksraad (EOR) kader van de Europese Unie Horizon 2020 onderzoek en innovatie programma (subsidie overeenkomst n ° 685778). Dit werk werd gesteund door de biotechnologie en de biologische Sciences Research Council (BBSRC, grant nummers BB/M011186/1, BB/J014516/1). DB dankzij de BBSRC doctorale opleiding partnerschap Newcastle-Liverpool-Durham voor een studententijd en Durham University departement van biowetenschappen om bij te dragen naar de financiering van dit werk. Wij danken Ian Edwards voor zijn hulp en de afdeling van de Durham University departement van chemie massaspectrometrie voor hun instrumentele analyse van eiwit X. Wij zijn dankbaar voor zijn werk met het Virus-X project, en ook dank aan Claire Hatty en NanoTemper GmbH Arnthor Ævarsson voor leningen en assisteren bij het Prometheus NT.48 systeem voor dit project. Tot slot, dank aan Frances Gawthrop en Tozer Seeds voor hun steun in het kader van de BBSRC iCASE award.
Materials
| Lysozyme | Melford Laboratories | L38100 | Crystallised and lyophilised chicken egg white lysozyme. |
| The Durham pH Screen | Molecular Dimensions | MD1-101 | 96-well protein stability screen. See above for contents. |
| The Durham Salt Screen | Molecular Dimensions | MD1-102 | 96-well protein stability screen. See above for contents. |
| The Durham Osmolyte Screen | Various | #N/A | 96-well protein stability screen, not commercially available at the time of publication. See above for contents. |
| SYPRO Orange | Invitrogen | S6651 | Widely used fluorescent dye for protein staining in gels and DSF. |
| 96-well PCR Plate | Starlab | 1403-7700 | Semi-skirted clear plastic for use with AB 7500 Fast RT-PCR System. |
| 7500 Fast Real-time PCR System | Applied Biosystems | 4362143 | 96-well format RT-PCR system. Alternative systems can be used. Analysis of data performed using free, open-access software NAMI. AB software tailored to DSF experiments using the 7500 Fast available at additional cost. |
| Prometheus NT.48 | NanoTemper Technologies | #N/A | Label-free DSF system with up to 48-sample capacity. Can calculate unfolding temperatures (Tm and Tonset), critical denaturant concentrations (Cm), free folding energy (ΔG and ΔΔG), and aggregation results (Tagg) using built-in software. |
| Prometheus NT.48 Series nanoDSF Grade Standard Capillaries | NanoTemper Technologies | PR-C002 | Prometheus NT.48 Series nanoDSF Grade Standard Capillaries. "High sensitivity" variants are available at a higher cost for use with low-concentration samples (<200 µg ml-1). |
References
- Kapust, R. B., Waugh, D. S. Controlled intracellular processing of fusion proteins by TEV protease. Protein Expression and Purification. 19 (2), 312-318 (2000).
- Cordingley, M. G., Register, R. B., Callahan, P. L., Garsky, V. M., Colonno, R. J. Cleavage of small peptides in vitro by human rhinovirus 14 3C protease expressed in Escherichia coli. Journal of Virology. 63 (12), 5037-5045 (1989).
- Hjorleifsdottir, S., Aevarsson, A., Hreggvidsson, G. O., Fridjonsson, O. H., Kristjansson, J. K. Isolation, growth and genome of the Rhodothermus RM378 thermophilic bacteriophage. Extremophiles. 18 (2), 261-270 (2014).
- Alva, V., Nam, S. Z., Söding, J., Lupas, A. N. The MPI bioinformatics Toolkit as an integrative platform for advanced protein sequence and structure analysis. Nucleic Acids Research. 44, 410-415 (2016).
- McPherson, A. Protein Crystallization. Methods in molecular biology. 1607, 17-50 (2017).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Reinhard, L., Mayerhofer, H., Geerlof, A., Mueller-Dieckmann, J., Weiss, M. S. IUCr Optimization of protein buffer cocktails using Thermofluor. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 69 (2), 209-214 (2013).
- Boivin, S., Kozak, S., Meijers, R. Optimization of protein purification and characterization using Thermofluor screens. Protein Expression and Purification. 91 (2), 192-206 (2013).
- Kozak, S., Lercher, L., Karanth, M. N., Meijers, R., Carlomagno, T., Boivin, S. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular NMR. 64 (4), 281-289 (2016).
- Semisotnov, G. V., Rodionova, N. A., Razgulyaev, O. I., Uversky, V. N., Gripas’, A. F., Gilmanshin, R. I. Study of the “molten globule” intermediate state in protein folding by a hydrophobic fluorescent probe. Biopolymers. 31 (1), 119-128 (1991).
- Grøftehauge, M. K., Hajizadeh, N. R., Swann, M. J., Pohl, E. Protein-ligand interactions investigated by thermal shift assays (TSA) and dual polarization interferometry (DPI). Acta Crystallographica Section D: Biological Crystallography. 71, 36-44 (2015).
- Steinberg, T. H., Jones, L. J., Haugland, R. P., Singer, V. L. SYPRO Orange and SYPRO Red Protein Gel Stains: One-Step Fluorescent Staining of Denaturing Gels for Detection of Nanogram Levels of Protein. Analytical biochemistry. 239, 223-237 (1996).
- Burstein, E. A., Vedenkina, N. S., Ivkova, M. N. Fluorescence and the location of tryptophan residues in protein molecules. Photochemistry and Photobiology. 18 (4), 263-279 (1973).
- Haffke, M., Rummel, G., Boivineau, J., Münch, A., Jaakola, V. -. P. nanoDSF: label-free thermal unfolding assay of G-protein-coupled receptors for compound screening and buffer composition optimization. Application Note NT-PR-008. , (2016).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparsematrix screening of chemical space. Nature Methods. 12 (9), 859-865 (2015).
- Laskowski, R. A. PDBsum: summaries and analyses of PDB structures. Nucleic Acids Research. 29 (1), 221-222 (2001).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical biochemistry. 104 (2), 300-310 (1980).
- Welch, W. J., Brown, C. R. Influence of molecular and chemical chaperones on protein folding. Cell stress & chaperones. 1 (2), 109-115 (1996).
- Diamant, S., Eliahu, N., Rosenthal, D., Goloubinoff, P. Chemical chaperones regulate molecular chaperones in vitro and in cells under combined salt and heat stresses. The Journal of biological chemistry. 276 (43), 39586-39591 (2001).
- Yancey, P. H. Organic osmolytes as compatible, metabolic and counteracting cytoprotectants in high osmolarity and other stresses. Journal of Experimental Biology. 208 (15), 2819-2830 (2005).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D Biological Crystallography. 62 (1), 32-47 (2006).
- de Marco, A., Vigh, L., Diamant, S., Goloubinoff, P. Native folding of aggregation-prone recombinant proteins in Escherichia coli by osmolytes, plasmid- or benzyl alcohol- overexpressed molecular chaperones. Cell Stress & Chaperones. 10 (4), 329 (2005).
- Berman, H. M., et al. The protein data bank. Nucleic acids research. 28 (1), 235-242 (2000).
- Bougouffa, S., Radovanovic, A., Essack, M., Bajic, V. B. DEOP: A database on osmoprotectants and associated pathways. Database. 2014, 1-13 (2014).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Kung, C. E., Reed, J. K. Fluorescent molecular rotors: a new class of probes for tubulin structure and assembly. Biochemistry. 28 (16), 6678 (1989).
- Iio, T., Itakura, M., Takahashi, S., Sawada, S. 9-(Dicyanovinyl)julolidine binding to bovine brain calmodulin. Journal of biochemistry. 109 (4), 499-502 (1991).
- Veros, C. T., Oldham, N. J. Quantitative determination of lysozyme-ligand binding in the solution and gas phases by electrospray ionisation mass spectrometry. Rapid Communications in Mass Spectrometry. 21 (21), 3505-3510 (2007).
- Kean, J., Cleverley, R. M., O’Ryan, L., Ford, R. C., Prince, S. M., Derrick, J. P. Characterization of a CorA Mg2+ transport channel from Methanococcus jannaschii using a Thermofluor-based stability assay. Molecular membrane biology. 25 (8), 653-661 (2008).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallographica Section F. 68 (5), 596-600 (2012).
- Morgan, H. P., Zhong, W., McNae, I. W., Michels, P. A., Fothergill-Gilmore, L. A., Walkinshaw, M. D. Structures of pyruvate kinases display evolutionarily divergent allosteric strategies. Royal Society open science. 1 (140120), (2014).
- Moretti, A., Li, J., Donini, S., Sobol, R. W., Rizzi, M., Garavaglia, S. Crystal structure of human aldehyde dehydrogenase 1A3 complexed with NAD+ and retinoic acid. Scientific reports. 6 (35710), (2016).

