マイクロスケールの熱泳動を使用してATPのアプタマーの結合部位のマッピング
Summary
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Abstract
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Introduction
分子間の相互作用は自然の基礎です。したがって、基礎および応用研究の多くの分野の科学者は、異なる種類の分子相互作用の基本的な原理を理解してみてください。マイクロ熱泳動(MST)は、バッファを自由に選択して、高速、正確な、コスト効率の高い、溶液中の分子間相互作用の品質管理特性評価を行うために、科学者を可能にします。 MSTを使用して、1,000以上の出版物は、ライブラリースクリーニング、結合事象の検証、競合アッセイ、および複数の結合パートナー1-8を用いた実験を含めた分析の種類を記述する、単独で2016年から、すでにあります。一般的に、MSTは、このような分子間相互作用の任意の種類の結合親和性(mmまでPM)、化学量論、および熱力学、のような古典的な結合パラメータ、の研究を可能にします。 MSTの大きな利点は、相互作用パートナーの大きさの独立した結合事象を研究する能力です。でもCHALlengingの小核酸アプタマーとの相互作用(15-30塩基)等の小分子、薬物、抗生物質、または代謝産物などの標的を定量することができます。
アプタマー-ターゲット相互作用を特徴づけるために、現在の最先端の技術は、実験室強く、非常に複雑されているか、またはアプタマー-小分子相互作用9,10を定量化することができません。表面プラズモン共鳴(SPR)はゲル状、19をプロービングにライン、アッセイ11,12と、本当にそのような等温滴定熱量測定(ITC)13-15、定組成溶離16、平衡ろ過17,18としてラベルフリー熱量測定アプローチを、ベースシフトアッセイ、stopped-流FL uorescence分光法20,21、蛍光異方性(FA)22,23、単一分子FL uorescenceイメージング24,25、およびバイオ層干渉(BLI)は26も不正確またはアプタマー、小分子と非互換ですか、相互作用。その他principaこれらのメソッドのリットルの問題は、低感度、高サンプル消費、固定化、表面の質量輸送の制限、および/またはバッファの制限です。これらの技術の唯一のいくつかは、凝集、吸着効果のための統合制御を提供します。
MSTは、アプタマーおよび小分子27-29、ならびにそのようなタンパク質30-33のような他の標的との間の相互作用を研究するために、この制限を克服するために、科学者のための強力なツールを表します。技術は、温度勾配を介して分子の動きに依存しています。呼ばれるこの有向運動、「熱泳動は、「サイズ、電荷、および分子34,35の水和殻に依存します。分子へのリガンドの結合を直接変更熱泳動移動度が得られ、これらのパラメータのうちの少なくとも1つを変化させます。小さなサイズを有するリガンドは、結合した状態に結合していないからサイズ変更の面で大きな影響がないかもしれませんが、彼らがdrを持つことができます水和殻および/または電荷にamatic効果。結合パートナーとの相互作用後の分子の熱泳動運動の変化は、基本的な結合パラメータ2,7,34,36,37の定量化を可能にします。
図1Aに示されているように、MSTデバイスは、蛍光検出の場合と同じ光学系を用いて、ガラスキャピラリー内のサンプル上に集束赤外線レーザーで構成されています。レーザは温度勾配(2-6℃のΔT)を確立しながら、トリプトファン6または蛍光標識された相互作用パートナー3,8のの固有のFL uorescenceを介してタンパク質の熱泳動的動きを監視することができます。空間、ΔTで生じる温度差はソーレーによって定量することができる高温の領域での枯渇または分子の蓄積につながるCOEF Fiのcient(S T)。
G "/>
C ホット加熱された領域内の濃度を表し、及びcの寒さは、初期の寒冷地での濃度です。
図1B、それぞれの時間スケールによって分離することができる別の相からなるMSTの移動プロファイル(時間トレース)における典型的なMSTの実験結果に示すように初期蛍光を正確出発蛍光を定義し、光退色またはphotoenhancementをチェックするために温度勾配が存在しない場合に最初の5秒で測定されます。温度ジャンプ(T-ジャンプ)において蛍光変化熱泳動移動前の段階を示しています。この蛍光の初期の減少は、量子収率uorophore FLの熱的変化に依存しています。定常状態分布に達するまで、熱泳動相が原因分子の熱泳動的動きのために、蛍光が減少(または増加)に従います。レーザがオフにされた後、図1(b)に示すように、逆TJUMPと蛍光増分子の同時逆拡散を観察することができます。基本的な結合パラメータにアクセスするために、相互作用パートナーの異なるモル比を分析し、比較します。光学可視分子が一定に保たれると非標識リガンドの増加量が供給され、一方、典型的には、16の異なる比率は、一つMST実験で研究されています。 2つの結合パートナーとの相互作用は、熱泳動の変化を誘導し、したがって、正規化されたFL uorescenceで、次のように計算されるF ノルム 、:
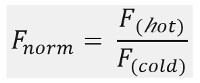
冷たい ホット &F Fは、MSTトレースのデFiのNEDの時点でFL uorescence強度を平均化表します。結合親和性(K dまたはEC 50値)CURVによって計算することができます。電子フィッティング( 図1C)。
全体的に、MSTは、いかなる種類の分子相互作用を研究するための強力なツールです。および25-ntの短い一本鎖DNAアプタマーDH25.42(7.9キロダルトン);この原稿は、小分子アデノシン三リン酸(0.5 kDaのATP)との間で挑戦的な相互作用を特徴づけるためのプロトコルを提供しています。原稿の間に、ATP分子上のアプタマーの結合部位は、ATPのアデニングループにダウンマッピングされます。
Protocol
Representative Results
Discussion
品質コントロール:
非特異的表面への試料物質の付着/吸着、ならびに凝集効果、親和性データの質に劇的な影響を与えます。しかし、わずか数最先端の技術は、これらの影響を監視し、回避するために、正確かつ迅速なオプションを提供しています。 MSTは、技術的なセットアップの段階的な最適化を可能にする、検出し、これらの問題を克服するのに役立つ統合された品…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者は何の確認応答がありません。
Materials
| Aptamer binding buffer | 20 mM Tris pH7.6; 300 mM NaCl; 5 mM MgCl2; 0.01%Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT-ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at – 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at – 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at – 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at – 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at – 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at – 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at – 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at – 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
References
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5′-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).

