La cartographie du site de liaison d'un aptamère sur ATP utilisant MicroScale thermophorèse
Summary
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Abstract
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Introduction
L'interaction entre les molécules est la base de la nature. Par conséquent, les scientifiques dans de nombreux domaines de la recherche fondamentale et appliquée tentent de comprendre les principes fondamentaux des interactions moléculaires de différents types. MicroScale thermophorèse (MST) permet aux scientifiques d'effectuer la caractérisation précise rapide, rentable et de qualité contrôlée des interactions moléculaires en solution, avec un libre choix de tampons. Il y a déjà plus de 1000 publications en utilisant MST, à partir de 2016 seulement, décrivant les différents types d'analyses, y compris des projections de la bibliothèque, les validations d'événements, des essais de compétition, et les expériences de liaison avec plusieurs partenaires de liaison 1-8. En général, le MST permet l'étude des paramètres de liaison classiques, tels que l'affinité de liaison (pM mM), stoechiométrie, et de la thermodynamique, de tout type d'interaction moléculaire. Un grand avantage de MST est la possibilité d'étudier des événements de liaison indépendants de la taille des partenaires d'interaction. Même chalinteractions lenging entre les petites aptamères d'acides nucléiques (15-30 nt) et des cibles telles que des petites molécules, des médicaments, des antibiotiques, ou métabolites peuvent être quantifiés.
Les technologies actuelles state-of-the-art pour caractériser les interactions aptamère-cibles sont soit en laboratoire intense et très complexe ou ne parviennent pas à quantifier les interactions aptamère-petite molécule 9,10. Surface Plasmon Resonance (SPR) à base de dosages 11,12 et approches colorimétriques vraiment sans étiquette, comme Calorimétrie titration isotherme (ITC) 13-15, élution isocratique 16, l' équilibre fi ltration 17,18, en ligne de sondage 19, gel – passer des tests, arrêt – fl ux fl uorescence spectroscopie 20,21, anisotropie de fluorescence (FA) 22,23, une seule molécule fl uorescence imagerie 24,25, et Bio-couche interférométrie (BLI) 26 sont également soit imprécis ou incompatible avec la molécule d'aptamères-petite interactions. Autres principal enjeux de ces méthodes sont une faible sensibilité, une consommation élevée de l'échantillon, l'immobilisation, les limitations de transport de masse sur les surfaces, et / ou des restrictions de mémoire tampon. Seules quelques-unes de ces technologies offrent des contrôles intégrés pour l'agrégation et d'adsorption des effets.
MST représente un outil puissant pour les scientifiques de surmonter cette limitation pour étudier les interactions entre les aptamères et les petites molécules 27-29, ainsi que d' autres cibles telles que les protéines 30-33. La technologie repose sur le mouvement de molécules à travers des gradients de température. Ce mouvement dirigé, appelé "thermophorèse," dépend de la taille, la charge, et la coquille d'hydratation de la molécule 34,35. La liaison d'un ligand à la molécule directement altérer au moins l'un de ces paramètres, ce qui entraîne une mobilité thermophorétique changé. Ligands avec de petites tailles peuvent ne pas avoir un impact considérable en termes de changement de taille de la non liée à l'état lié, mais ils peuvent avoir dr effets Amatic sur la coque et / ou la charge hydratation. Les changements dans le mouvement thermophorétique des molécules après interactions avec le partenaire de liaison permet la quantification des paramètres de liaison de base 2,7,34,36,37.
Comme cela est représenté sur la figure 1A, le dispositif MST est constitué d'un laser infrarouge focalisé sur l'échantillon à l' intérieur des tubes capillaires en verre optique en utilisant les mêmes que pour la détection de la fluorescence. Le mouvement thermophorétique de protéines via le fl uorescence intrinsèque de tryptophanes 6 ou d'un partenaire d' interaction 3,8 marqué par fluorescence peut être surveillée tandis que le laser établit un gradient de température (AT de 2-6 ° C). La différence de température dans l' espace, AT, conduit à l'épuisement ou l' accumulation de molécules dans le domaine de température élevée, qui peut être quantifiée par la Soret coef fi cient (S T):
g "/>
c représente la concentration à chaud dans la région chauffée et froid c est la concentration initiale dans la zone froide.
Comme le montre la figure 1B, un exemple typique de résultats expérimentaux MST dans un profil de mouvement MST (trace de temps), composé de différentes phases, qui peuvent être séparés par leurs échelles de temps respectives. La fluorescence initiale est mesurée au cours des 5 premières secondes en absence de gradient de température pour définir la fluorescence de départ précis et pour vérifier photoblanchiment ou photoenhancement. Le saut de température (T-Jump) représente la phase dans laquelle les changements de fluorescence avant le mouvement thermophorétique. Cette diminution initiale de la fluorescence dépend des changements de chaleur dépendant de fl uorophore rendement quantique. La phase de thermophorèse suit, dans laquelle les baisses de fluorescence (ou augmente) en raison du mouvement thermophorétique des molécules jusqu'à ce que la distribution à l'état d'équilibre est atteint.Le tjump inverse et rétrodiffusion concomitante de molécules fluorescents peuvent être observées comme indiqué dans la figure 1B après le laser est éteint. Pour accéder aux paramètres de liaison de base, différents rapports molaires des partenaires d'interaction sont analysées et comparées. En règle générale, 16 rapports différents sont étudiés dans une expérience MST, tandis que la molécule visible optique est maintenue constante et est alimentée avec une quantité croissante du ligand non marqué. L'interaction entre les deux partenaires de liaison induit des changements dans la thermophorèse, et donc dans la fluorescence normalisée, F norme, qui est calculé comme suit:
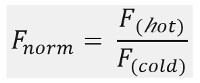
F chaud et froid F représentent en moyenne fl intensités uorescence au dé fi nies points de temps des traces du MST. Les affinités de liaison (K d ou CE 50 valeurs) peuvent être calculées par curve montage (figure 1C).
Dans l'ensemble, le MST est un outil puissant pour étudier les interactions moléculaires de toute nature. Ce manuscrit propose un protocole pour caractériser l'interaction difficile entre la petite triphosphate molécule d'adénosine (ATP; 0,5 kDa) et le 25-nt court ADNss aptamère DH25.42 (7,9 kDa). Au cours du manuscrit, le site de liaison de l'aptamère sur la molécule d'ATP est mappée vers le bas pour le groupe adénine de l'ATP.
Protocol
Representative Results
Discussion
Les contrôles de qualité:
l'adhérence non spécifique / adsorption de l'échantillon de matériau sur les surfaces, ainsi que des effets d'agrégation, ont une influence considérable sur la qualité des données d'affinité. Cependant, seulement quelques technologies state-of-the-art offrent des options précises et rapides pour surveiller et éviter ces effets. MST offre des contrôles de qualité intégrés qui détectent et aident à surmonter ces problèmes, permettant l…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs ont pas accusés de réception.
Materials
| Aptamer binding buffer | 20 mM Tris pH7.6; 300 mM NaCl; 5 mM MgCl2; 0.01%Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT-ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at – 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at – 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at – 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at – 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at – 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at – 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at – 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at – 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
References
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5′-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).

