Primer für die Immunhistochemie auf gefriergeschnitten Rat Brain Tissue: Beispiel Färbung für Mikroglia und Neuronen
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Immunhistochemie ist eine weit verbreitete Technik zur Erfassung der Anwesenheit, den Ort und die relative Häufigkeit von Antigenen in situ. Dieser Einführungs Level-Protokoll beschreibt die Reagenzien, Geräte und Techniken erforderlich, um die immunhistochemische Färbung von Hirngewebe von Nagern zu vervollständigen, mit Markern für Mikrogliazellen und neuronale Elemente als Beispiel. Genauer gesagt, dieses Papier ist ein Schritt-für-Schritt-Protokoll für fluoreszierende Visualisierung von Mikroglia und Neuronen über die Immunhistochemie für Iba1 und Pan-neuronalen sind. Fluoreszenzdoppelmarkierung ist besonders nützlich für die Lokalisierung mehrerer Proteine innerhalb der gleichen Probe, die Bereitstellung der Möglichkeit, genau zu beobachten Wechselwirkungen zwischen Zelltypen, Rezeptoren, Liganden und / oder der extrazellulären Matrix in Relation zueinander sowie Protein Co- Lokalisierung innerhalb einer einzelnen Zelle. Im Gegensatz zu anderen Visualisierungstechniken kann Fluoreszenz Immunhistochemie Färbeintensität Abnahmedie Wochen bis Monate nach Färbung, es sei denn, entsprechende Vorkehrungen getroffen werden. Trotz dieser Einschränkung in vielen Anwendungen Fluoreszenzdoppelmarkierung über Alternativen wie 3,3'-Diaminobenzidintetrahydrochlorid (DAB) oder alkalische Phosphatase (AP) bevorzugt, da die Fluoreszenz zeiteffizienter und ermöglicht genauere Unterscheidung zwischen zwei oder mehr Marker. Die Diskussion enthält Tipps zur Fehlerbehebung und Beratung zum Erfolg zu fördern.
Introduction
Immunohistochemie ist ein Verfahren zum Nachweis von Antigenen (dh Proteine) in Gewebeschnitten unter Verwendung von primären Antikörpern, die spezifisch gegen die Antigene von Interesse binden. Immunhistochemie wurde von JR Marrack 1934 Pionierarbeit geleistet, als er festgestellt, dass Antikörper könnten Antigene mit großer Spezifität 1 zu lokalisieren. Ab 1942 einige der ersten in-vitro-Studien unter Verwendung von fluoreszierenden Antikörpern immunhistochemisch visualisieren veröffentlicht wurden 2,3, wonach die erste in vivo histochemische Studie veröffentlicht 4. Während der 1960er drei Jahrzehnte nach dem Beginn des immunhistochemische Verfahren begann, Enzym-konjugierten Antikörper als sekundäre Reagentien verwendet werden. Diese Methoden wurden gleichzeitig und unabhängig voneinander in Frankreich und in den USA 5,6 entwickelt. Heute, ein breites Spektrum von Antikörpern bietet unendlich viele Möglichkeiten für die Immunhistochemie Studien 7.
"> Das übergeordnete Ziel dieser Korrespondenz ist es, eine kurze Einführung in immunhistochemischen Färbung bereitzustellen; es ist nicht als eine umfassende und abschließende Bewertung dieser Technik werden in der Methode beschrieben werden immunhistochemischen Techniken für zwei Antigene präsentiert (Marker für die Mikroglia und. Neuronen) für die Färbung von Paraformaldehyd perfundiert beginnt Saccharose kryogeschützt, gefriergeschnitten Rattenhirn. Die immunhistochemische Färbung mit Blockierungs unspezifische Antigen-Bindung an die Hintergrundfärbung zu reduzieren. Als nächstes wird die Inkubation mit dem primären Antikörper können zur Bindung an ein spezifisches Antigen im Gewebe. Im Anschluss an die primären Antikörper, ein anderer Antikörper, bezeichnet als sekundärer Antikörper, aufgebracht wird, um den primären Antikörper auf einen konjugierten Visualisierungssignal 8 zu verknüpfen. Der sekundäre Antikörper zielt auf das Immunglobulin G (IgG) Domäne spezifisch für die Spezies, in denen das primäre Antikörper gezüchtet wurde. Der sekundäre Antikörper verstärkt das Signal, des primären Antikörpers, da die Fab Regionen ter sekundären Antikörper binden sich an mehreren Stellen auf dem IgG-Domäne des primären Antikörpers. Entweder Enzymen oder fluoreszierenden Moleküle an die Fc-Bereiche der sekundären Antikörper konjugiert ermöglichen Visualisierung. Beispielsweise ist ein Kaninchen-Anti-Iba1 Primärantikörper ein Kaninchen-IgG-Molekül spezifisch für Iba1. Wenn Esel-Anti-Kaninchen-IgG als sekundärer Antikörper verwendet, wird es zu erkennen und zu mehreren Regionen des Kaninchen-Anti-Iba1 IgG (siehe 1), zu binden. Der Esel-Antikörper kann durch verschiedene Verfahren sichtbar gemacht werden. Diese Entsprechung konzentriert sich auf Erfassung eines Fluorophors an den sekundären Antikörper, der den primären Antikörper erkennt, zur Sichtbarmachung durch Fluoreszenzmikroskopie konjugiert. In fluoreszierenden Immunhistochemie kann eine Kernfärbung wie Hoechst oder DAPI verwendet, um alle Kerne zu visualisieren.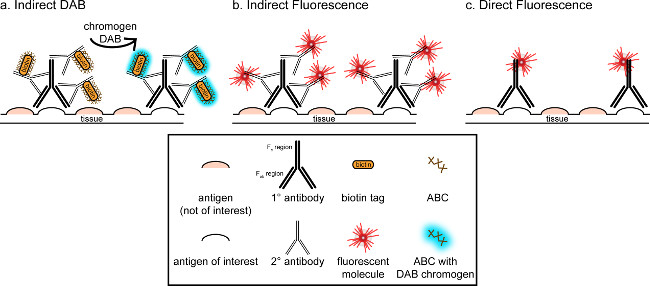
Abbildung 1: SchEmatic Darstellung direkte vs. indirekte Antikörper-Markierungstechniken. Antikörper binden an das Antigen von Interesse und kann durch sekundäre Antikörper, die gegen die Spezies des primären Antikörper erzeugt amplifiziert werden. Diese Technik kann durchgeführt werden unter Verwendung von Avidin-Biotin-Komplex (ABC) zur Verstärkung und DAB zur Visualisierung (A) oder einem direkt konjugierten fluoreszierenden Sekundärantikörper (B). Alternativ können primäre Antikörper direkt mit vielen verschiedenen Tags, einschließlich Biotin oder ein Fluorophor (C) konjugiert werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ein alternatives Verfahren zur Visualisierung von immunhistochemischen Färbung verwendet 3,3'-Diaminobenzidintetrahydrochlorid (DAB; siehe 1 und 2). Dies unterscheidet sich von Fluoreszenz, die durch Verwendung eines biotinylierten oderMeerrettich-Peroxidase (HRP) konjugierten Sekundärantikörper, die ein Enzym, um DAB zu einem Niederschlag, der unter Hellfeldmikroskopie sichtbar zu konvertieren bietet. In Fällen, in denen eine einzige Antigen von Interesse ist oder Färbung ist erforderlich, langlebig zu sein, kann DAB besser geeignet als Fluoreszenzfärbung ist. Allerdings DAB-Färbung nicht zur Differenzierung zwischen mehreren Markern gut geeignet, vor allem, wenn zwei nukleäre Antigene von Interesse. Informationen zur DAB Materialien und Protokoll Änderungen, wenden Tabelle 1. Alternativ Nitroblautetrazoliumchlorid / 5-Brom-4-chlor-3-indolyl-phosphat (NBT / BCIP) kann verwendet werden, um eine alkalische Phosphatase (AP) konjugierten sekundären visualisieren Antikörper.
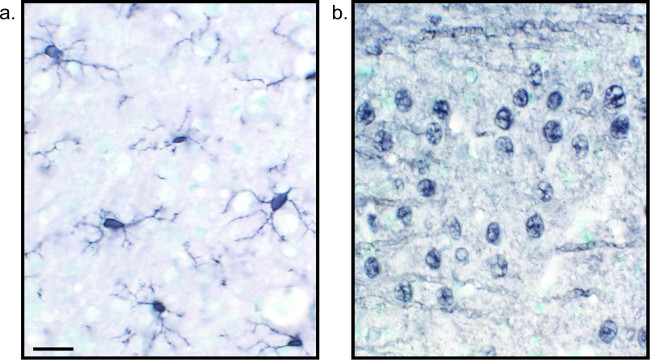
Abb. 2: Repräsentative Bilder von Nickel-verstärkten DAB einfach markierten Rattenhirngewebeschnitten Rattenhirn-sections, die mit Nickel-verstärkten DAB für Iba1 (A) und Pan-neuronalen (B) markiert sind, ermöglichen eine lang anhaltende Analyse von Mikrogliazellen oder Neuronen allein. Maßstabsleiste 20 um. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Man muß bedenken die geschätzte Häufigkeit des Antigens von Interesse innerhalb des Gewebes analysiert. Indirekten Methoden (wie oben beschrieben) sind nützlich für Ziele mit geringer Häufigkeit. Wenn das Antigen von Interesse in besonders hoher Zahl, können direkte Verfahren aufgebracht werden. Direkte Verfahren umfassen einen primären Antikörper, der direkt an ein Visualisierungssignal konjugiert ist, und damit keine sekundären Antikörpers erforderlich ist. Diese Methode vereinfacht die Färbung Prozess, aber beseitigt die durch indirekte Methoden erreicht Verstärkung. Mit Hilfe eines direkt konjugierten primären Antikörper beseitigt auch Kreuzreaktivität Sekundärantikörperals Doppelmarkierung.
Diese Mitteilung beschreibt die Protokoll für Doppelmarkierung mit Iba1 und Pan-neuronalen (Details in Tabelle 1). Iba1 Flecken Mikroglia-Aktivierung in vielen Staaten, darunter verzweigte, hyperverzweigte, aktiviert, amoeboid und Stange. Pan-neuronalen Flecken neuronalen Axonen, Dendriten, und Soma. Seit Iba1 Flecken meisten Mikroglia und Pan-neuronalen Ziele das Neuron ist diese Kombination von Flecken nützlich gewinnen ein umfassendes Verständnis von Mikroglia-Neuron-Interaktionen.
Zusammengefasst beruht die immunhistochemische Färbung auf die sorgfältige Auswahl von Antikörpern. Da die Fragestellung wird präziser können Antikörper, Antigene, um alternative angehoben wünschen übrig. Um einen bestimmten Mikrogliaaktivierung Staaten abzielen, kann man sich dafür entscheiden, CD45 oder CD68-Antikörper verwenden, anstatt Iba1. Ferner wird bei der Arbeit mit Mäusen, F4 / 80 können die erforderlichen Ergebnisse zu liefern. In ähnlicher Weise kann die neuronale Elemente spezifisch mit Antikörpern ra gezieltsierten gegen den Zellkern, synapse (Pre- oder Post), Axon, und Wachstumskegel. Darüber hinaus gibt es andere Markierungen, die das Alter des Neurons (Doppel-Cortin, NeuN) unterscheiden und neuronalen Regeneration (GAP-43).
Protocol
Representative Results
Discussion
Das übergeordnete Ziel dieser Mitteilung war die Immunhistochemie Verfahren für den Leser einzuführen. Hierzu wird das Beispiel der Doppelmarkierung mit Iba1 und Pan-neuronale Antigene an Mikroglia und Neuronen in Paraformaldehyd perfundiert beobachten, wurde Saccharose kryogeschützt, gefriergeschnitten Rattenhirn verwendet.
Diese Technik lässt sich an endlosen Zwecken dienen werden. Ein Array von verschiedenen Antigenen in einer Vielzahl von Gewebetypen, wie beispielsweise, jedoch nich…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

