16.10:
용해평형
43,344 Views
•
•
용해도 평형은 solute 종의 용해 및 강수량이 동일한 속도로 발생할 때 확립됩니다. 이 평형은 충치에서 정수에 이르기까지 많은 자연 및 기술 적 과정을 뒷받침합니다. 화합물 용해도에 영향을 미치는 요인에 대한 이해는 이러한 프로세스의 효과적인 관리에 필수적입니다. 이 섹션에서는 이전에 도입된 평형 개념 과 도구를 용해 및 강수량과 관련된 시스템에 적용합니다.
용해도 제품
물질의 용해도는 본질적으로 0 (불용성 또는 아껴서 용용성)에서 무한대 (miscible)에 다를 수 있음을 기억하십시오. 유한 한 용해도를 가진 용해도는 용해도를 초과하는 양으로 용매에 첨가될 때 포화 용액을 얻을 수 있으며, 그 결과 포화 용액과 과도한 용액의 이질적인 혼합물과 과도하게 용해가 혼합된 불용솔테가 생성된다. 예를 들어, 은염화물의 포화 용액은 아래에 표시된 평형이 확립된 것입니다.
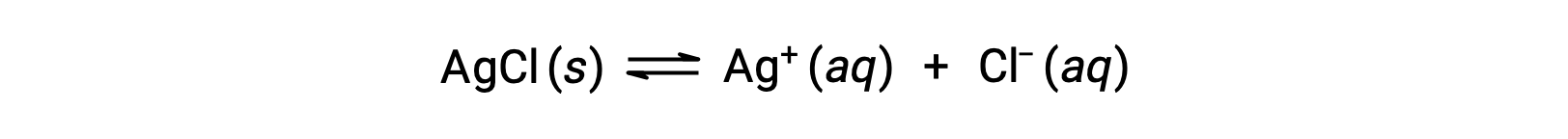
이 솔루션에서, 고체 AgCl의 과잉은 용해및 해리 – 이러한 수성 이온이 결합하고 고체 AgCl을 형성침하는 것과 같은 속도로이온을 생성합니다. 은염화물은 드물게 용해성 염이므로 용액에 용해된 이온의 평형 농도는 상대적으로 낮습니다.
이와 같은 용해도 평형에 대한 평형 상수는 용해도 제품 상수, Ksp라고하며,이경우
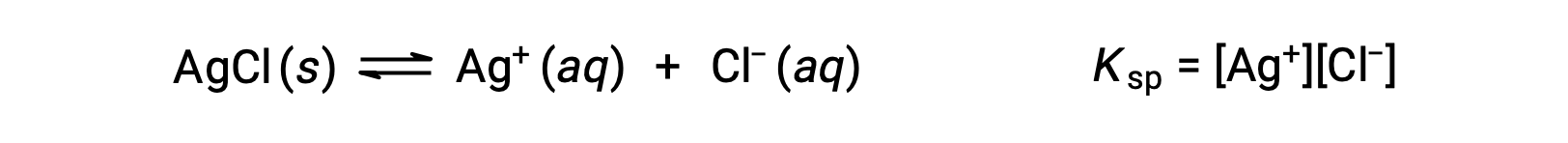
가스와 솔루트만 평형 상수 식으로 표현되므로 K스프는 용해되지 않은 AgCl에 대한 용어를 포함하지 않는다는 것을 기억하십시오.
K스프 및 용해도
약간 수용성 이온 화합물의 K스폰은 용해 공정이 해리 및 용해만 을 수반하는 경우 측정된 용해도와 간단하게 관련이 있을 수 있습니다.
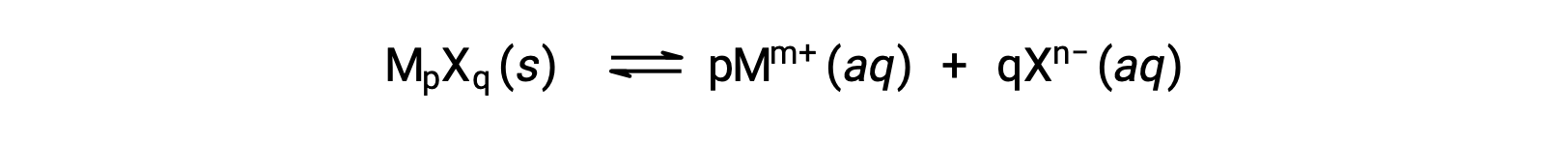
이러한 경우 KSP 값을 제공된 용해도에서 파생하거나그 반대의 경우도 마찬가지입니다. 이러한 종류의 계산은 포화 용액 의 리터 당 용해 솔직성의 두더지로 측정 된 화합물의 어금니 용해도를 사용하여 가장 편리하게 수행됩니다.
강수량 예측
탄산칼슘과 그 솔바게이온 사이의 평형을 설명하는 방정식은 다음과 이다.
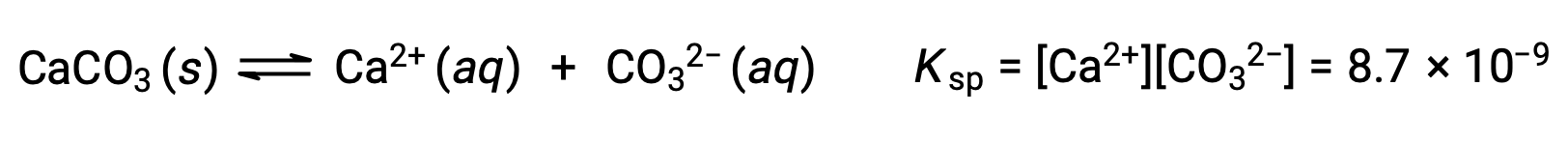
이 평형은 탄산칼슘으로 물을 포화시킴으로써 형성된 용액뿐만 아니라 Ca2+ 및 CO32-이온을 포함하는 임의의 수성 용액에 확립된다는 것을 깨닫는 것이 중요합니다. 예를 들어, 탄산 나트륨과 질산칼슘의 수용성 용액을 혼합하는 것을 고려해 보십시오. 혼합물에서 칼슘과 탄산이온의 농도가 반응 지수를 산출하지 않으면, Q,용해도 생성물을 초과하는 Q, K스프,침전이 발생하지 않습니다. 이온 농도가 용해도 제품보다 큰 반응 지수를 산출하면 강수량이 발생하여 평형이 확립될 때까지 농도가 낮아집니다(Q = KSp). 강수량을 예측하기 위해 Q와 K스프를 비교하는 것은 평형에 대한 수업에서 처음 도입된 반응의 방향을 예측하는 일반적인 접근법의 예입니다. 용해도 평형의 특정 경우 :
Q & K스프: 반응이 전진 방향으로 진행됩니다(용액이 포화되지 않고 강수량이 관찰되지 않음)
Q > K스프: 반응은 역방향으로 진행됩니다 (용액이 과포화되고 강수량이 발생합니다)
