16.10:
Equilibrio di solubilità
43,344 Views
•
•
Gli equilibri di solubilità sono stabiliti quando la dissoluzione e la precipitazione di una specie di soluto si verificano a velocità uguali. Questi equilibri sono alla base di molti processi naturali e tecnologici, che vanno dalla carie alla purificazione dell’acqua. La comprensione dei fattori che influenzano la solubilità composta è quindi essenziale per una gestione efficace di questi processi. Questa sezione applica concetti e strumenti di equilibrio introdotti in precedenza ai sistemi che comportano dissoluzione e precipitazione.
Il prodotto di solubilità
Ricordiamo che la solubilità di una sostanza può variare da zero (insolubile o sparingly solubile) all’infinito (miscible). Un soluto con solubilità finita può produrre una soluzione satura quando viene aggiunto ad un solvente in una quantità superiore alla sua solubilità, risultando in una miscela eterogenea della soluzione satura e del soluto in eccesso e non disciolto. Ad esempio, una soluzione satura di cloruro d’argento è una soluzione in cui è stato stabilito l’equilibrio mostrato di seguito.
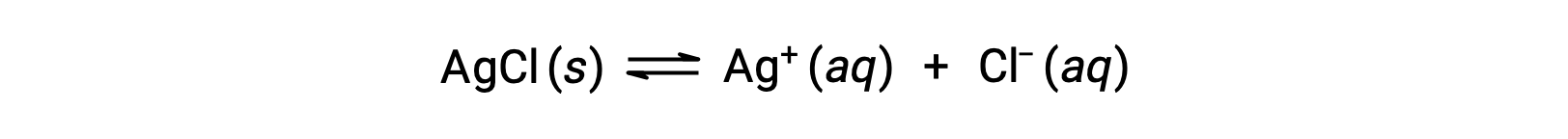
In questa soluzione, un eccesso di AgCl solido si dissolve e si dissocia per produrre ioniAcquosi Ag + e Cl– allo stesso ritmo con cui questi ioni acquosi si combinano e precipitano per formare AgCl solido. Poiché il cloruro d’argento è un sale parsimoniosamente solubile, la concentrazione di equilibrio dei suoi ioni disciolti nella soluzione è relativamente bassa.
La costante di equilibrio per gli equilibri di solubilità come questo è chiamata costante del prodotto di solubilità, Ksp, in questo caso
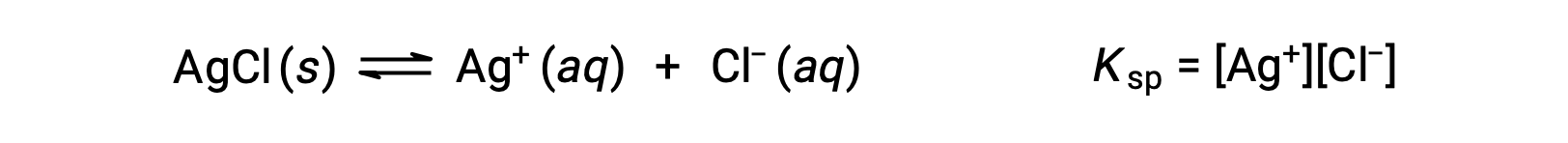
Ricordiamo che solo i gas e i soluti sono rappresentati in espressioni costanti di equilibrio, quindi ksp non include un termine per l’AgCl non dissociato.
Ksp e solubilità
Il Ksp di un composto ionico leggermente solubile può essere semplicemente correlato alla sua solubilità misurata a condizione che il processo di dissoluzione comporti solo dissociazione e soluzione, ad esempio:
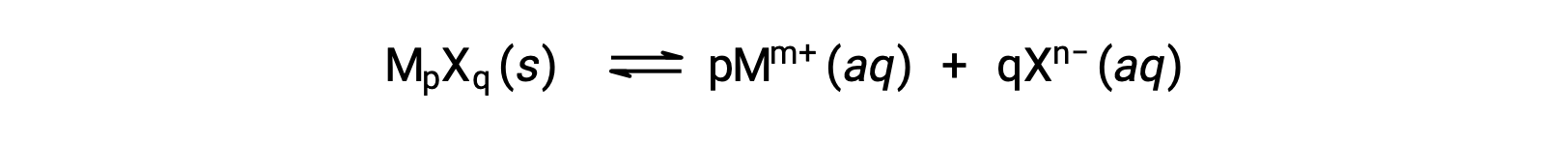
Per casi come questi, si possono ricavare valori Ksp dalle solubilità fornite, o viceversa. Calcoli di questo tipo vengono eseguiti più convenientemente utilizzando la solubilità molare di un composto, misurata come talpe di soluto disciolto per litro di soluzione satura.
Previsione delle precipitazioni
L’equazione che descrive l’equilibrio tra carbonato di calcio solido e i suoi ioni solvati è:
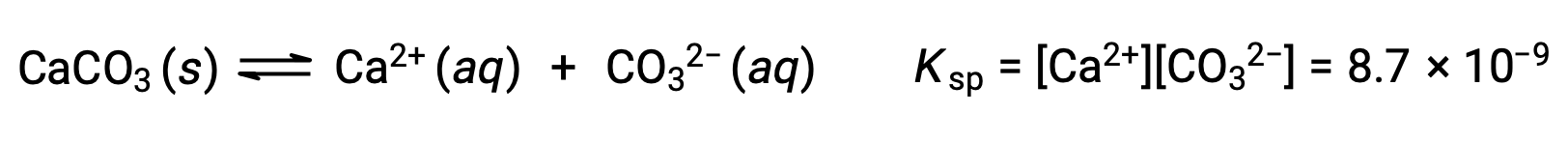
È importante rendersi conto che questo equilibrio è stabilito in qualsiasi soluzione acquosa contenente ioni Ca2+ e CO32, non solo in una soluzione formata da acqua saturante con carbonato di calcio. Si consideri, ad esempio, la miscelazione di soluzioni acquose dei composti solubili carbonato di sodio e nitrato di calcio. Se le concentrazioni di ioni calcio e carbonato nella miscela non producono un quoziente di reazione, Q, che supera il prodotto di solubilità, Ksp, non si verificherà alcuna precipitazione. Se le concentrazioni di ioni producono un quoziente di reazione maggiore del prodotto di solubilità, si verificherà una precipitazione, abbassando tali concentrazioni fino a quando non viene stabilitol’equilibrio ( Q = Ksp). Il confronto tra Q e Ksp per prevedere le precipitazioni è un esempio dell’approccio generale alla previsione della direzione di una reazione introdotta per la prima volta nelle lezioni sull’equilibrio. Per il caso specifico degli equilibri di solubilità:
Q < Ksp: la reazione procede nella direzione in avanti (la soluzione non è satura; nessuna precipitazione osservata)
Q > Ksp: la reazione procede nella direzione inversa (la soluzione è supersatura; si verificherà precipitazione)
Questo testo è adattato da Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
