6.3:
Energia interna
24,681 Views
•
•
Il totale di tutti i possibili tipi di energia presenti in una sostanza è chiamato energia interna (U), a volte simboleggiata come E. Supponiamo che un sistema con energia interna iniziale, Uiniziale, subisca un cambiamento di energia (trasferimento di lavoro o calore), e l’energia interna finale del sistema è Ufinale. La variazione dell’energia interna è uguale alla differenza tra Ufinale e Uiniziale.
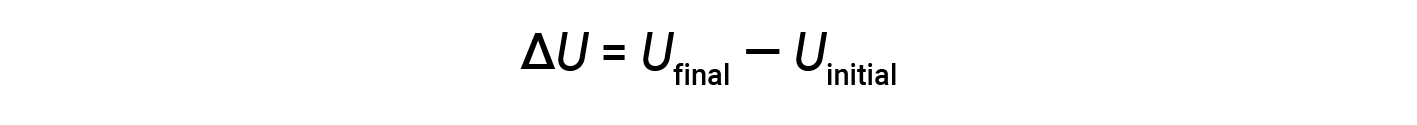
Sebbene i valori per Ufinale e Uiniziale non possano essere determinati per un sistema, la prima legge della termodinamica richiede solo il valore di ΔU, che può essere determinato anche senza conoscere i valori di Ufinale e Uiniziale. Un valore positivo di ΔU risulta quando Ufinale > Uinizialee indica che il sistema ha guadagnato energia dall’ambiente circostante. Un valore negativo di ΔU si ottiene quando Ufinale < Uinizialee indica che il sistema ha perso energia per l’ambiente circostante.
Il calore (energia termica) e il lavoro (energia meccanica) sono i due diversi modi in cui un sistema può scambiare energia con l’ambiente circostante. L’energia viene trasferita in un sistema quando assorbe calore (q) dall’ambiente circostante o quando l’ambiente circostante lavora (w) sul sistema.
Ad esempio, l’energia viene trasferita nel filo metallico a temperatura ambiente se è immersa nell’acqua calda (il filo assorbe il calore dall’acqua) o quando il filo viene rapidamente piegato avanti e indietro (il filo diventa più caldo a causa del lavoro svolto su di esso). Entrambi i processi aumentano l’energia interna del filo, che si riflette in un aumento della temperatura del filo. Al contrario, l’energia viene trasferita da un sistema quando il calore viene perso dal sistema o quando il sistema funziona sull’ambiente circostante. Ad esempio, la combustione del carburante per razzi rilascia un’enorme quantità di calore ed esegue anche lavori sull’ambiente circostante applicando una forza su una distanza (causando il decollo di uno space shuttle da terra). Entrambi i processi riducono l’energia interna del sistema.
La relazione tra energia interna, calore e lavoro può essere rappresentata dall’equazione:
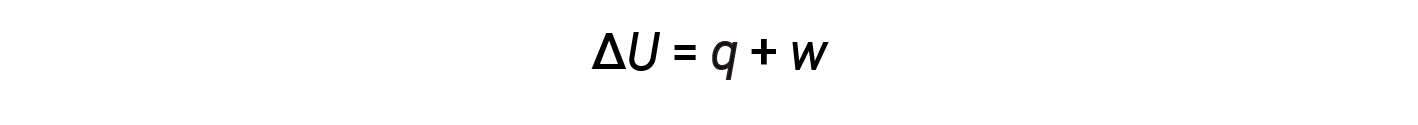
Questa è una versione della prima legge della termodinamica, e mostra che l’energia interna di un sistema cambia attraverso il flusso di calore in entrata o in uscita dal sistema o il lavoro viene eseguito su o dal sistema. I segni per il calore e il lavoro dipendono dal fatto che il sistema guadagni o perda energia. Q positivo è il flusso di calore nel sistema dall’ambiente circostante, mentre q negativo è il flusso di calore fuori dal sistema. Il lavoro, w, è positivo se viene eseguito sul sistema e negativo se viene eseguito dal sistema.
Quando q e w sono entrambi positivi (>0), ΔU è sempre positivo (>0), e l’energia interna del sistema aumenta. Quando q e w sono entrambi negativi (<0), ΔU è sempre negativo (<0) e l'energia interna del sistema diminuisce. Se q e w hanno convenzioni di segno diverse, allora il segno di ΔU dipende dalle magnitudini relative di q e w.
L’unità SI di energia, calore e lavoro è il joule (J).
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 5.3: Entalpia.
