14.10:
Предположение малого x
43,131 Views
•
•
Если реакция имеет небольшую константу равновесия, положение равновесия благоприятствует реагенты. В таких реакциях может произойти изменение концентрации пренебрежимый, если исходные концентрации реагенты высоки, а значение Kc невелико. В таких условиях равновесная концентрация приблизительно равна исходной концентрации. Эта оценка может быть использована для упрощения расчетов равновесия при условии, что некоторые концентрации равновесия равны исходным концентрациям. Однако, чтобы сделать это предположение, изменение концентрации слабой кислоты или основание, то есть, x, должно быть меньше 5% от его начальной концентрации. Если x больше 5%, то для решения уравнения равновесия необходимо использовать квадратную формулу.
Расчет равновесных концентраций с использованием упрощенного предположения Алгебра
Каковы концентрации в равновесии 0.15 M раствор HCN?
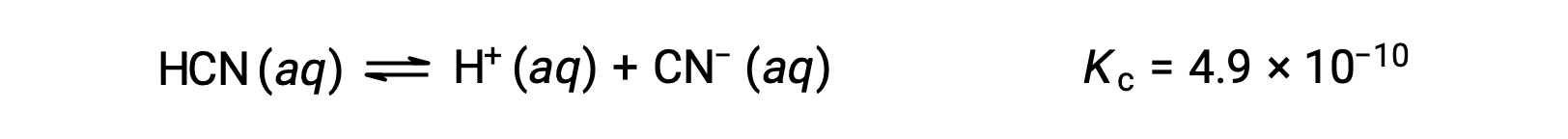
Использование x для представления концентрации каждого продукта в равновесии дает эту таблицу ЛЬДА.
| HCN (aq) | H+ (aq) | CN– (aq) | |
| Начальная концентрация (M) | 0.15 | 0 | 0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.15 – x. | x | x |
Замените термины равновесной концентрации на выражение Kc
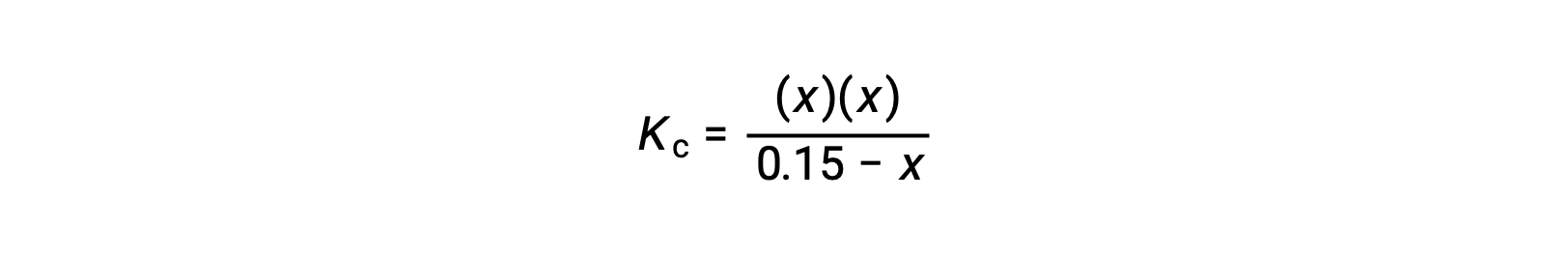
измените порядок на квадратичную форму и решите для x
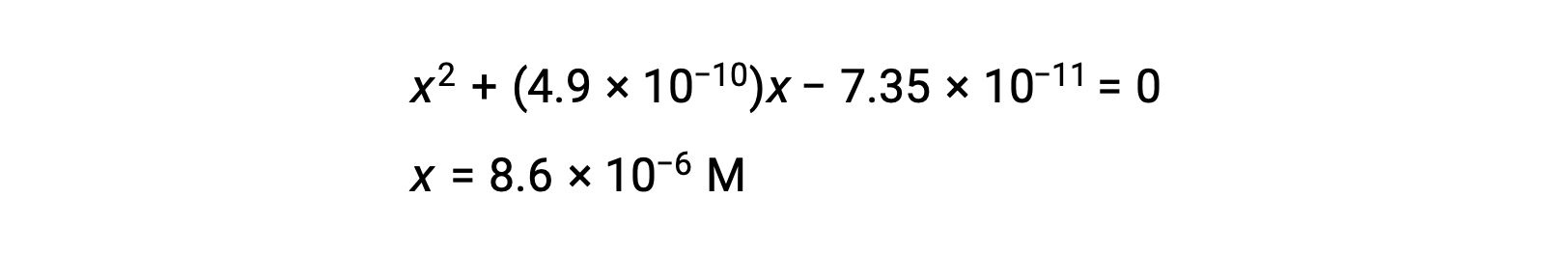
Таким образом, [H+] = [CN–] = x = 8.6 × 10–6 M и [HCN] = 0.15 – x = 0.15 M.
Обратите внимание, что изменение концентрации значительно меньше исходной концентрации (вследствие малого K), и поэтому начальная концентрация испытывает изменение пренебрежимый:

Это приближение позволяет более целесообразному математическому подходу к расчёту, который избегает необходимости решения для корней квадратного уравнения:
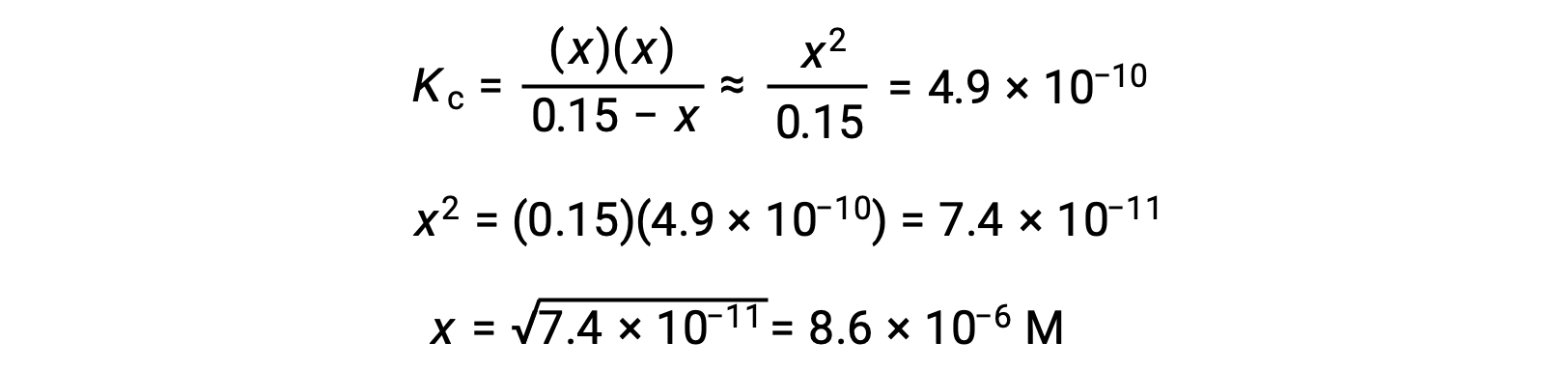
Вычисленное значение x фактически намного меньше первоначальной концентрации
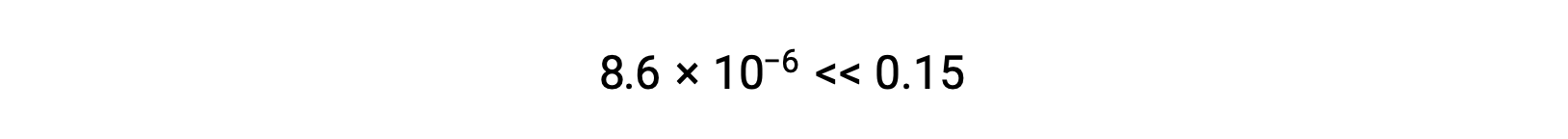
и таким образом, приближение было оправдано. Если такой упрощенный подход даст значение x, которое не оправдывает аппроксимацию, то вычисление нужно будет повторить без выполнения аппроксимации.
Этот текст был адаптирован к расчетам равновесия Openstax, Химия 2е изд., раздел 13.4 .
