16.15:
Courbes de titrage acide-base
111,887 Views
•
•
Une courbe de titrage est un tracé d’une certaine propriété de la solution par rapport à la quantité de titrant ajouté. Pour les titrages acido-basiques, le pH de la solution est une propriété utile à surveiller car il varie de manière prévisible avec la composition de la solution et peut donc être utilisé pour surveiller la progression du titrage et détecter son point final. Le titrage acido-basique peut être réalisé avec un acide fort et une base forte, un acide fort et une base faible, ou une base forte et un acide faible.
Dans le cas d’un titrage réalisé pour 25,00 ml de HCl (acide fort) 0,100 M avec 0,100 M de NaOH (base forte), la courbe de titrage est visible en rouge dans la figure 1a. Dans le cas d’un titrage réalisé pour 25,00 ml de CH3COOH (acide faible) 0,100 M avec 0,100 M de NaOH, la courbe de titrage est visible en jaune dans la figure 1b.
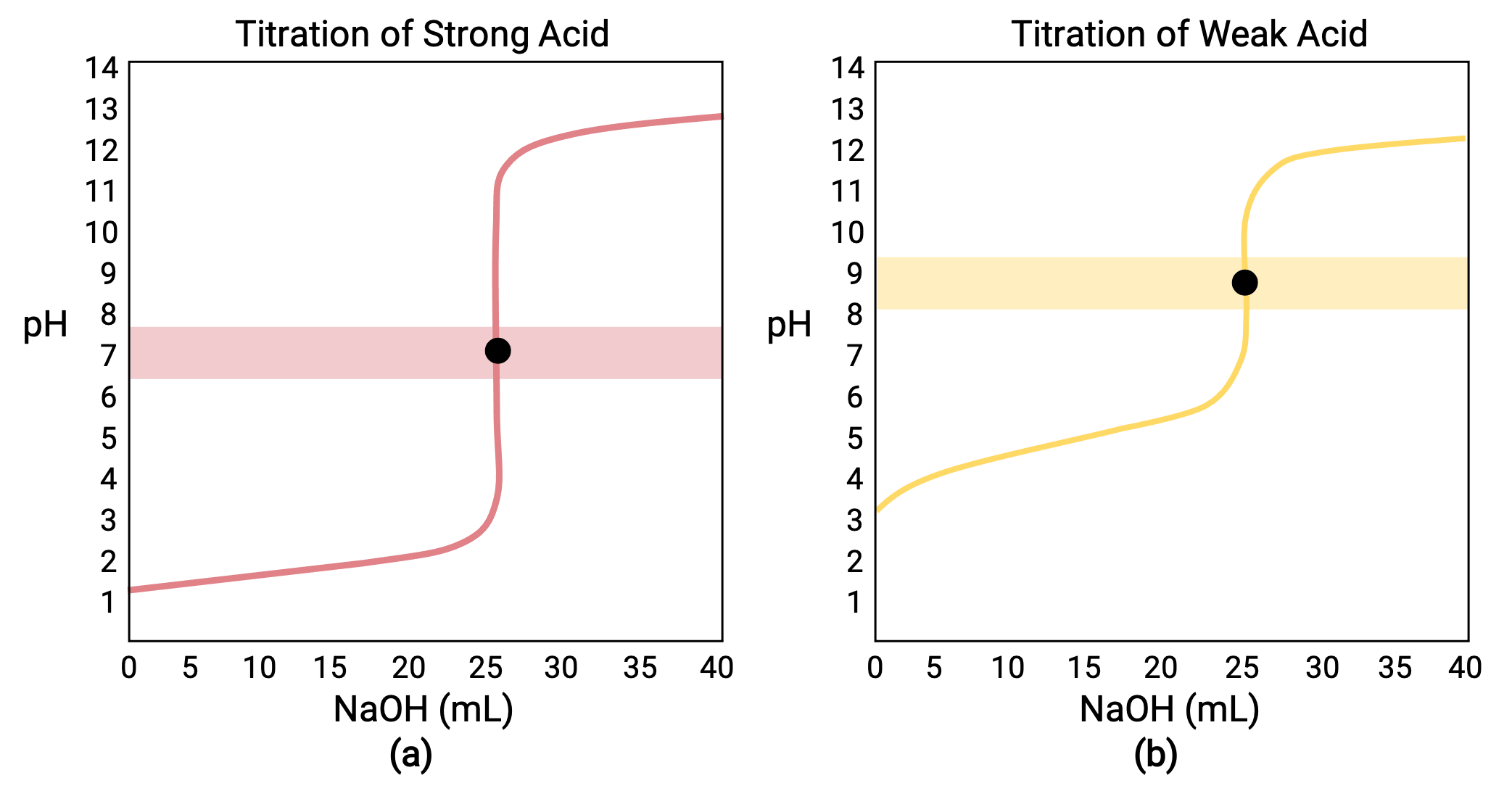
Figure 1 (a) La courbe de titrage pour le titrage de 25,00 ml de HCl (acide fort) 0,100 M avec NaOH (base forte) 0,100 M a un point d’équivalence de pH 7,00. (b) La courbe de titrage pour le titrage de 25,00 ml d’acide acétique (acide faible) 0,100 M avec NaOH (base forte) 0,100 M a un point d’équivalence de pH 8,72.
Le titrage d’une base forte ou faible avec un acide fort a une courbe en forme de S similaire ; cependant, la courbe est inversée car le pH commencera dans la région basique et diminuera avec l’ajout de l’acide fort. Le titrage d’un acide ou d’une base faible peut également être utilisé pour déterminer le Ka ou le Kb, respectivement.
Les quatre étapes d’un titrage :
- État initial (volume de titrant ajouté = 0 ml) : le pH est déterminé par l’acide titré ; comme les deux échantillons d’acide ont la même concentration, l’acide faible présente un pH initial plus élevé.
- Point de pré-équivalence (0 ml &60; V < 25 ml) : le pH de la solution augmente progressivement et l’acide est consommé par réaction avec le titrant ajouté ; la composition comprend l’acide n’ayant pas réagi et le produit de la réaction, sa base conjuguée.
- Point d’équivalence (V = 25 ml) : une augmentation drastique du pH est observée lorsque la composition de la solution passe d’acide à neutre (pour l’échantillon d’acide fort) à basique (pour l’échantillon d’acide faible), avec un pH déterminé par l’ionisation de la base conjuguée de l’acide.
- Point de post-équivalence (V > 25 ml) : le pH est déterminé par la quantité d’excès de base forte titrante ajoutée ; étant donné que les deux échantillons sont titrés avec le même titrant, les deux courbes de titrage apparaissent similaires à ce stade.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.7 : Titrages acido-basiques.
